题目内容
【题目】某学习小组通过查阅资料发现用KClO3和浓盐酸也可以制备氯气。为此该小组利用如图装置在实验室制取Cl2并探究其有关性质:
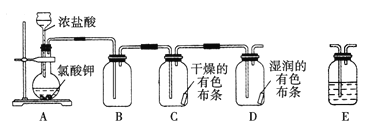
(1)装置A中存在一处错误,改正这处错误:______________。
(2)配平装置A中发生反应的化学方程式:____KClO3+____HCl(浓)=__KCl+___Cl2↑+___H2O,此反应中氧化产物与还原产物的物质的量之比为 ____________。请用单线桥标出该反应电子转移的方向和数目 ____________________。
(3)为了除去氯气中的氯化氢,需要在装置A、B之间添加装置E,装置E中所盛装的试剂为____。为了探究使有色布条褪色的是氯气还是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,装置E在整套装置中的添加位置为____(选填序号)。
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
(4)将氯气通入冷的石灰乳中,即可制得以______________(填化学式)为有效成分的漂白粉,发生反应的化学方程式为__________________________。
(5)另外一个学习小组就环境保护方面指出了上述装置的缺陷并给出了改进措施。该改进措施是____。
【答案】改长颈漏斗为分液漏斗 1;6;1;3;3 5:1 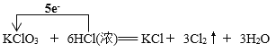 饱和食盐水 b Ca(ClO)2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 在装置D后增加一个盛装碱液的装置,吸收逸出的氯气
饱和食盐水 b Ca(ClO)2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 在装置D后增加一个盛装碱液的装置,吸收逸出的氯气
【解析】
A装置反应生成氯气,B中收集氯气,应该干燥后再通入C中,干燥的有色布条不褪色,D中湿润的有色布条褪色,检验有漂白性的物质是次氯酸,最后缺少尾气处理装置。
(1)装置中反应试剂是浓盐酸易挥发,需要用分液漏斗加入,改长颈漏斗为分液漏斗;故答案为:改长颈漏斗为分液漏斗;
(2)氯酸钾和浓盐酸反应生成氯气,氯化钾和水,氯元素发生归中反应,反应的化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O;在3molCl2用中有0.5mol是还原产物,2.5mol是氧化产物,氧化产物与还原产物的物质的量之比为5:1,单线桥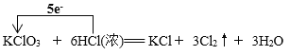 ;
;
(3)制备出的氯气含有挥发出的氯化氢,通过饱和食盐水可以除去,减小氯气的溶解性;探究使有色布条褪色的是氯气还是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,应在C装置前干燥氯气,选择装置B、C之间;故答案为:饱和食盐水;b;
(4)氯气与石灰乳反应生成氯化钙和次氯酸钙,反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分为CaCl2和Ca(ClO)2,其中Ca(ClO)2为漂白粉的有效成分,故答案为:Ca(ClO)2;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)氯气有毒排放到空气中污染环境,需要尾气吸收装置,在装置D后增加一个盛装浓碱液的装置,使碱液吸收逸出的氯气尾气,故答案为:在装置D后增加一个盛装碱液的装置,吸收逸出的氯气。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案