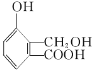
题目内容
【题目】已知室温下氨水中存在如下平衡:NH3H2O![]() NH4++OH-,在5份0.01mol·L-1
NH4++OH-,在5份0.01mol·L-1
的氨水中分别加入下列各物质:A、浓氨水B、纯水C、少量NaOH固体D、少量浓硫酸E、NH4Cl固体,按照要求填空:
(1)电离平衡会向逆向移动是___。
(2)c(NH4+)、c(OH-)都增大的是___,升温时氨水的Kb将___(填“增大”、“减小”或“不变”)。
(3)c(NH4+)增大,c(OH-)减小的是___。
(4)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显___性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=___。
【答案】C、E A 增大 D、E 中 ![]()
【解析】
氨水中存在:NH3H2ONH4++OH-,加水稀释促进一水合氨电离,加入含有铵根离子或氢氧根离子的物质抑制一水合氨电离,加入和铵根离子或氢氧根离子反应的物质促进一水合氨电离,据此分析。
![]() 加入少量氢氧化钠,
加入少量氢氧化钠,![]() 增大抑制一水合氨电离,加入少量氯化铵,
增大抑制一水合氨电离,加入少量氯化铵,![]() 增大,抑制一水合氨电离,所以抑制一水合氨电离的是CE,故答案为:CE;
增大,抑制一水合氨电离,所以抑制一水合氨电离的是CE,故答案为:CE;
![]() 向溶液中加入浓氨水,一水合氨电离平衡正向移动,溶液中
向溶液中加入浓氨水,一水合氨电离平衡正向移动,溶液中![]() 、
、![]() 都增大;物质的电离都是吸热的,升高温度,会促进氨水的电离,氨水的
都增大;物质的电离都是吸热的,升高温度,会促进氨水的电离,氨水的![]() 将增大,故答案为:A;增大;
将增大,故答案为:A;增大;
![]() 向溶液中加入少量浓硫酸,硫酸电离出的氢离子会中和掉氢氧根离子,促进一水合氨的电离,铵根离子浓度增大;向溶液中加入氯化铵,铵根离子浓度增大抑制一水合氨电离,则氢氧根离子浓度减小,故答案为:DE;
向溶液中加入少量浓硫酸,硫酸电离出的氢离子会中和掉氢氧根离子,促进一水合氨的电离,铵根离子浓度增大;向溶液中加入氯化铵,铵根离子浓度增大抑制一水合氨电离,则氢氧根离子浓度减小,故答案为:DE;
![]() 在 25
在 25 ![]() 下 , 平衡时溶液中
下 , 平衡时溶液中 ![]() , 根据物料守恒得
, 根据物料守恒得 ![]()
![]() , 根据电荷守恒得
, 根据电荷守恒得 ![]() , 溶液呈中性 ,
, 溶液呈中性 ,![]()
![]() 的电离常数
的电离常数 。
。

【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸(H2C2O4)的反应,记录如表所示的实验数据:
实验 编号 | 实验 温度 | 试管中所加试剂及其用量/mL | 溶液褪至无 色所需时间 /min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式 ______,当该反应以表中数据反应完全时转移电子数为______NA。
(2)V1=_______mL。
(3)根据表中的实验①、②数据,可以得到的结论是 _______。
(4)探究温度对化学反应速率的影响,应选择 _______(填实验编号)
(5)该小组根据经验绘制了n(Mn 2+)随时间变化的趋势如图1所示,但有同学查阅已有实验资料发现,该实验过程中n(Mn 2+)随时间变化的实际趋势如图2所示。
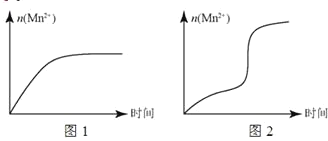
该小组同学根据图 2 所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
实验温度 /℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间/min | ||||
0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①小组同学提出的假设是________。
②若该小组同学提出的假设成立,应观察到________现象。