题目内容
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
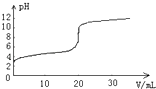
(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=______mol/L( 列出计算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol.
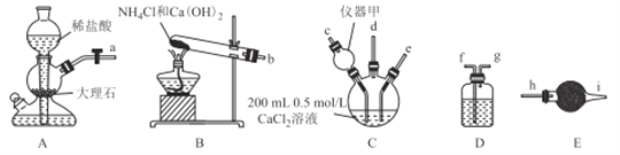
(3)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=![]() )的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
)的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.

④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
【答案】 a/2+10-b-10b-14 1072.7 0.01mol·L-1·min-1 10000 C < 180℃ 不
【解析】(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,根据电荷守恒,c(CH3COO-)+ c(OH-)= c(Li+)+ c(H+),因此c(CH3COO-)+10b-14 mol/L =![]() mol/L +10-b mol/L,整理得:c(CH3COO-) =
mol/L +10-b mol/L,整理得:c(CH3COO-) =![]() mol/L +10-b mol/L-10b-14 mol/L=(
mol/L +10-b mol/L-10b-14 mol/L=(![]() +10-b-10b-14)mol/L,故答案为:
+10-b-10b-14)mol/L,故答案为: ![]() +10-b-10b-14;
+10-b-10b-14;
(2)根据反应Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol可知,ΔH=反应物的键能之和-生成物的键能之和,则C≡O的键能为=(-41.3 kJ/mol)-(2×464kJ/mol)+(2×803kJ/mol+436kJ/mol)=1072.7 kJ/mol,故答案为:1072.7;
(3)① 2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),
CH3COOCH=CH2(g)+2CH3COOH(g),
起始(mol) 0.2 0.4 0.1 0 0
反应(mol) 2x 4x x x 2x
平衡(mol) 0.2-2x 0.4-4x 0.1-x x 2x
则![]() ×100%=10%,解得:x=0.05mol,0~10min内,用CO浓度变化表示的平均反应速率v(CO)=
×100%=10%,解得:x=0.05mol,0~10min内,用CO浓度变化表示的平均反应速率v(CO)= 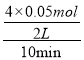 = 0.01mol·L-1·min-1;该温度下,该反应的平衡常数K=
= 0.01mol·L-1·min-1;该温度下,该反应的平衡常数K=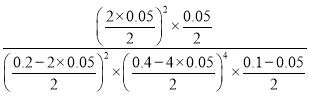 =10000,故答案为:0.01mol·L-1·min-1;10000;
=10000,故答案为:0.01mol·L-1·min-1;10000;
②A.V正(DME)=v逆(H2),表示的正逆反应速率不等,不是平衡状态,故A错误;B.该反应中气体的质量和体积始终不变,混合气体的密度始终不变,不表示是平衡状态,故B错误;C. ![]() =
=![]() ,该反应恰好气体的物质的量发生变化,因此混合气体的平均相对分子质量不再变化,说明是平衡状态,故C正确;D. c(CO):c(VAC)与起始浓度和反应的方程式有关,与平衡状态无关,故D错误;故选C;
,该反应恰好气体的物质的量发生变化,因此混合气体的平均相对分子质量不再变化,说明是平衡状态,故C正确;D. c(CO):c(VAC)与起始浓度和反应的方程式有关,与平衡状态无关,故D错误;故选C;
③根据图像,升高温度,二甲醚(DME)的转化率减小,说明平衡逆向移动,则反应的ΔH<0,180℃时,醋酸乙烯(VAC)选择性最高,最佳的反应温度为180℃,故答案为:<;180℃;
④保持温度不变,向反应釜中通入氩气增大压强,但物质的浓度不变,平衡不移动,故答案为:不。

【题目】Ⅰ.下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素④、⑨形成的氢化物的稳定性顺序为_____>______(填化学式)。
(3)表中元素③、④、⑥、⑦的原子半径大小为____>____>___>___(填元素符号)。
Ⅱ.A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。(2) E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯 已知: 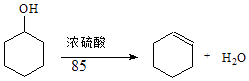
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
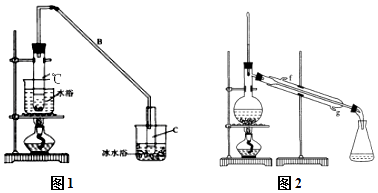
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品. ①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品: ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后,用(填编号)洗涤环己烯.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.NaOH溶液
②再将环己烯按图2装置蒸馏,冷却水从(填f或g)口进入,蒸馏时要加入生石灰,目的是 .
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 .
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最简单的方法是 .
A.酸性KMnO4溶液
B.用金属钠
C.测定沸点
D.溴的四氯化碳溶液.