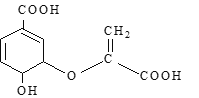
题目内容
【题目】某学习小组在实验室中利用下图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中含硫化合物的组成。

实验步骤:
步骤I如图连接装置,检查装置气密性,装入药品;
步骤II旋开滴液漏斗活塞与旋塞,并点燃酒精喷灯;
步骤III当硬质玻璃管中固体质量不再改变时,停止加热,继续向烧瓶中滴水一段时间
步骤IV实验结束后,将D中所得溶液加水配制成250mL溶液;
……
请回答:
(1)步骤III中,停止加热后还需继续向烧瓶中滴水一段时间,其目的为___________________。
(2)在C、D装置之间不需要防倒吸装置的理由是_______________________________________。
(3)步骤IV中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有_____________________。
(4)取25.00mL步骤IV 中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g。则FexSy的化学式为________________。
(5)有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案____(填“是”或“否”)合理,原因为_____________________。
(6)反应后D装置所得溶液中除含有Na2SO4外,还可能含有Na2SO3。现用滴定法测定溶液中Na2SO3的含量。可供选择的试剂:①0.1000mol/LKMnO4酸性溶液;②0.1000mol/LH2O2溶液;③0.1000mol/LKI淀粉溶液;④0.1000 mol/LBaCl2溶液;⑤0.1000mol/LHCl溶液。
①所选试剂应装在_____(填“酸式”或“碱式”) 滴定管中。
②所利用的反应原理为___________________________________(用离子方程式表示)。
【答案】 继续生成O2,驱赶装置内残留的SO2,使生成的SO2全部被NaOH溶液吸收 SO2中含不溶于NaOH溶液的O2 250mL容量瓶、胶头滴管 FeS2 否 部分SO2被氧化;空气中的CO2和水蒸气可能使干燥管增重 酸式 2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O
【解析】本实验的目的为:测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中含硫化合物的组成。观察装置,A装置中产生足量的氧气经干燥后,进入C装置与FexSy在加热条件下反应,生成硫的氧化物,进入D被氢氧化钠吸收。
(1)步骤III中,停止加热后还需继续向烧瓶中滴水一段时间,继续产生氧气,FexSy其实已经反应完了,那么其目的为将生成的SO2全部被NaOH溶液吸收,所以答案为:继续生成O2,驱赶装置内残留的SO2,使生成的SO2全部被NaOH溶液吸收;
(2)此装置中,不需要防倒吸装置,虽然易溶于水,但是其中还有难溶于水的氧气,不会因为其易溶于水而使气压迅速降低发生倒吸,故答案为:SO2中含不溶于NaOH溶液的O2;
(3)步骤IV中配制250mL溶液时,因为是要配制一定体积的溶液,故需要容量瓶,所以所需的玻璃仪器除玻璃棒和烧杯外,还有250ml 容量瓶和胶头滴管;
(4)C装置中产生的气体,主要应为SO2,所以D中生成Na2SO3,取25.00mL步骤IV中所配溶液(取了十分之一溶液),加入足量的双氧水,将其氧化为Na2SO4,再加入足量盐酸酸化的BaCl2溶液,所得沉淀为BaSO4,质量为4.66g,其物质的量为0.02mol,250ml溶液中n(BaSO4)=0.2mol,根据S守恒:n(BaSO4)= n(Na2SO4)= n(SO2)=0.2mol,故12.0gFexSy中n(S)=0.2mol,m(S)=6.2g,m(Fe)=5.6g,n(Fe)=0.1mol,所以,x:y=1:2,故FexSy的化学式为FeS2;
(5)装置D的作用是吸收装置中产生的SO2,若改为装有足量碱石灰的干燥管空气中的CO2和水蒸气可能使干燥管增重,而且SO2可能被氧化,使增重偏大;故答案为:. 否 部分SO2被氧化,空气中的CO2和水蒸气可能使干燥管增重;
(6)反应后D装置所得溶液中除含有Na2SO4外,还可能含有Na2SO3。要用滴定法测定溶液中Na2SO3的含量,即利用Na2SO3的还原性,故选一个氧化剂,还要有颜色的变化来判断反应的终点,所以只能选择①0.1000mol/LKMnO4酸性溶液,因其具有强氧化性,只能装在酸式滴定管中,所利用的反应原理为:2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案