题目内容
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,在元素周期表中的位置是________。
(2)N元素非金属性比As强,下列说法正确的是_______
①热稳定性:NH3<AsH3
②酸性:HNO3>H3AsO4
③原子半径:N<As
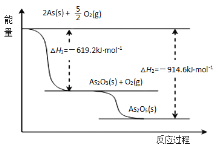
(3)请依据如图信息写出As2O5分解为As2O3的热化学方程式_______。
(4)查阅文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如图:

已知:As2S3不溶于水;As2O3微溶于水。
①As2S3、Na3AsS3中的硫元素均为-2价,碱浸过程中发生的反应______(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的离子方程式为_______。
③过程Ⅲ得到纯净As2O3固体的系列操作包括_____、_____、_____。
④过程Ⅲ中,其它条件相同时仅改变溶液pH,发现酸性越强,As2O3的产率越高,可能的原因是_______。
【答案】第四周期VA族 ②③ As2O5(s)=As2O3(s)+O2(g) △H=+295.4kJ/mol 不是 2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O 过滤 洗涤 干燥 酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度,反应速率加快或者增加氢离子浓度,平衡正向移动促进反应的进行,有利于提高As2O3的产率
【解析】
(1)As的原子结构示意图为:![]() ,有4个电子层,最外层有5个电子,与N同族,故位于第四周期V A族;
,有4个电子层,最外层有5个电子,与N同族,故位于第四周期V A族;
(2)元素非金属性越强,对应氢化物的热稳定性越好,最高价氧化物对应水化物的酸性越强,As电子层数比N多2,非金属性N>As;
(3)根据盖斯定律可知,反应热与过程无关,只与始态、终态有关,由图可知:△H+|△H1|=|△H2|,据此计算;
(4)碱浸过程中没有元素化合价的变化,过程Ⅲ为溶液到固体,需要经过浓缩结晶,过滤,洗涤,烘干,发生反应的离子方程式为2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O,酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率。
(1)As的原子结构示意图有4个电子层,最外层有5个电子,位于第四周期,V A族;
(2)元素非金属性越强,对应氢化物的热稳定性越好,最高价氧化物对应水化物的酸性越强,非金属性N>As,①NH3的热稳定性比AsH3好,②HNO3的酸性比H3AsO4强,③As电子层数比N多2,N的原子半径比As的原子半径小,故答案为:②③;
(3)根据盖斯定律可知,反应热与过程无关,只与始态、终态有关,由图可知:△H+|△H1|=|△H2|,△H=|△H2||△H1|==914.6kJ/mol619.2kJ/mol= +295.4kJ/mol,故该反应的热化学方程式为:As2O5(s)==As2O3(s)+O2(g) △H= +295.4kJ/mol;
(4)①碱浸过程中没有元素化合价的变化,故该反应不是氧化还原反应;
②过程Ⅲ发生反应的离子方程式为2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
③过程Ⅲ为溶液到固体,需要经过浓缩结晶,过滤,洗涤,干燥;
④酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度,反应速率加快或者增加氢离子浓度,平衡正向移动促进反应的进行,有利于提高As2O3的产率。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】科学家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是______
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将______(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a_____0;ΔS______0,(填“>”、“<”或“=”)。
(2)已知(K为平衡常数):N2(g)+3H2(g)![]() 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是_______。