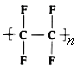题目内容
【题目】常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
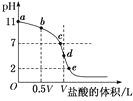
(1)该温度时NH3·H2O的电离常数K=__;
(2)比较b、c、d三点时的溶液中,由水电离出的OH-浓度大小顺序为__;
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是__(填字母,下同);
A.c(H+)·c(OH-) B.![]() C.
C.![]() D.
D.![]()
(4)根据以上滴定曲线,下列说法正确的是__;
A.点b所示溶液中:c(NH![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=___,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为___。
【答案】10-5 d>c>b ACD D 1 ![]()
【解析】
(1)根据图示,没有滴加盐酸时,0.1mol·L-1的氨水的pH=11,在溶液中NH3·H2O电离,电离方程式为NH3·H2O![]() NH4++OH-,溶液的pH=11,则c(OH-)=
NH4++OH-,溶液的pH=11,则c(OH-)=![]() ,忽略溶液中水电离出来的H+,则c(NH4+)=c(OH-);NH3·H2O的电离程度较弱,发生电离的NH3·H2O约占所有NH3·H2O的1%,可以忽略不计,则溶液中c(NH3·H2O)=0.1mol·L-1,则NH3·H2O的电离常数
,忽略溶液中水电离出来的H+,则c(NH4+)=c(OH-);NH3·H2O的电离程度较弱,发生电离的NH3·H2O约占所有NH3·H2O的1%,可以忽略不计,则溶液中c(NH3·H2O)=0.1mol·L-1,则NH3·H2O的电离常数![]() ;
;
(2)根据题意d点两种溶液恰好完全反应,生成NH4Cl,NH4+在溶液中能够水解,促进水的电离;b、c两点表示的溶液中c点NH3·H2O被中和得较多,剩余的NH3·H2O较少,对水的电离抑制较少,因此b、c、d三点的溶液中,由水电离出的OH-浓度大小顺序为d>c>b;
(3)b点到c点过程中,NH3·H2O被中和得越来越多,但是还有剩余;
A.在水溶液中,溶液中的c(H+)·c(OH-)=Kw,温度不变,Kw不变,A符合题意;
B.b点到c点过程中,NH3·H2O被中和得越来越多,pH越来越小,c(H+)越来越大,c(OH-)越来越小,则由b点到c点的过程中,![]() 越来越大,B不符合题意;
越来越大,B不符合题意;
C.![]() 为NH3·H2O的电离平衡常数的表达式,温度不变,电离平衡常数不变,C符合题意;
为NH3·H2O的电离平衡常数的表达式,温度不变,电离平衡常数不变,C符合题意;
D.![]() 为NH4+的水解平衡常数表达式,温度不变,水解平衡常数不变,D符合题意;
为NH4+的水解平衡常数表达式,温度不变,水解平衡常数不变,D符合题意;
答案选ACD;
(4)A.b点溶液,有一半的NH3·H2O与HCl反应,得到NH3·H2O和NH4Cl等物质的量的混合溶液,根据物料守恒,有c(NH4+)+c(NH3·H2O)=2c(Cl-);NH3·H2O会电离,电离方程式为NH3·H2O![]() NH4++OH-,NH4+会水解,水解方程式为NH4++H2O
NH4++OH-,NH4+会水解,水解方程式为NH4++H2O![]() NH3·H2O+H+,NH3·H2O电离会使得溶液呈碱性,NH4+水解使得溶液呈酸性,现溶液呈碱性,说明NH3·H2O的电离程度大于NH4+的水解程度,则c(NH4+)>c(NH3·H2O),可得c(NH4+)>c(Cl-)>c(NH3·H2O);根据电荷守恒,有c(NH
NH3·H2O+H+,NH3·H2O电离会使得溶液呈碱性,NH4+水解使得溶液呈酸性,现溶液呈碱性,说明NH3·H2O的电离程度大于NH4+的水解程度,则c(NH4+)>c(NH3·H2O),可得c(NH4+)>c(Cl-)>c(NH3·H2O);根据电荷守恒,有c(NH![]() )+c(H+)=c(OH-)+c(Cl-),则c(NH
)+c(H+)=c(OH-)+c(Cl-),则c(NH![]() )+c(H+)>c(OH-)+c(NH3·H2O),A错误;
)+c(H+)>c(OH-)+c(NH3·H2O),A错误;
B.根据图示,c点溶液的pH=7,有c(H+)=c(OH-),根据电荷守恒,有c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-),B错误;
C.d点NH3·H2O恰好被完全反应,溶液中只有NH4Cl,由于NH4+会水解,但水解是微弱的,因此c(Cl-)>c(NH4+)>c(H+)>c(OH-),C错误;
D.滴定过程中,如果只加入了少量了HCl,则等式c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),该等式符合电荷守恒,可能存在,D正确;
答案选D;
(5)根据题意d点恰好完全反应,加入盐酸的体积为VmL,而氨水溶液的体积恰好也是VmL,说明两溶液的溶质的浓度相同,盐酸的浓度也为0.1mol·L-1,c(H+)=0.1mol·L-1,pH=1;
如果忽略NH4+的水解,设e点加入盐酸的体积为xmL,e点溶液的pH=2,c(H+)=0.01mol·L-1,则有![]() ,则可得
,则可得![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
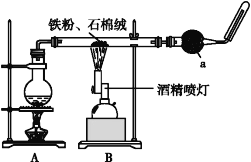
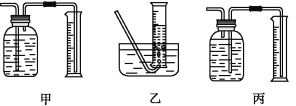
(1)该实验反应的反应方程式为:___。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为__。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____ | Ⅲ.反应后的溶液中阳离子为___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①___ ②Fe2++2OH—=Fe(OH)2↓(白色) 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |