题目内容
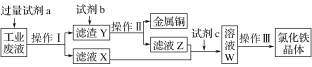
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:则下列说法正确的是
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为: 2Fe2++Cl2===2Cl-+2Fe3+
D. 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+
【答案】C
【解析】
含有FeCl2、FeCl3、CuCl2的工业废液中加入过量的铁粉,得到氯化亚铁溶液和铁粉、铜粉的混合物,铁粉、铜粉的混合物中加入过量盐酸可得到金属铜和氯化亚铁溶液,氯化亚铁溶液中通入过量氯气得到氯化铁溶液,氯化铁溶液在氯化氢气流中蒸发得氯化铁晶体。
根据以上分析,试剂a是铁、试剂b是稀盐酸,故A错误;操作Ⅰ是过滤、操作Ⅱ是过滤、操作Ⅲ是蒸发,所用仪器不相同,故B错误;试剂c是氯气,氯气与氯化亚铁反应的离子方程式是: 2Fe2++Cl2===2Cl-+2Fe3+,故C正确;酸性KMnO4溶液可以氧化Fe2+、Cl-,所以不能用酸性KMnO4溶液检验溶液W中是否还有Fe2+,故D错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下列实验所述的变化过程与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH 溶液滴入FeSO4 溶液中 | 石蕊溶液滴入氯水中 | 向 K2Cr2O7 溶液 中滴加浓硫酸 | CO2 通入 Na2O2 |
现象 | 产生白色沉淀,最 终变为红褐色 | 溶液变红,随后迅速褪色 | 溶液黄色变浅, 橙色加深 | 固体逐渐变白 |
A. A B. B C. C D. D