题目内容
下图所示是中学化学里常见纯净物A—L间的反应关系,其中A、H、E、F为单质且E、F为气体,B在常温下是无色液体,C是淡黄色固体,L是红褐色固体。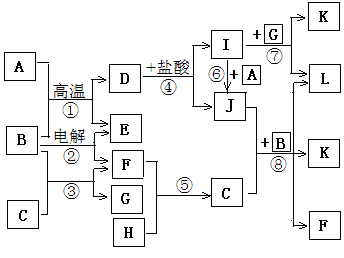
请根据图示判断并回答下列问题:
(1)单质A中所含元素在周期表中的位置是 ;
(2)反应③的化学方程式为 ;
(3)反应④的离子方程式为 ;
(4)反应⑧的离子方程式为 ;
(5)反应②发生过程中,当有3.01×1024个电子发生转移时,电解消耗物质B的质量为 g,同时阴极生成的气体的体积为 L(换算为标准状况下的体积)。
(1)第四周期Ⅷ族(2分)
(2)2Na2O2+2H2O=4NaOH+O2↑(3分)
(3)Fe3O4+8H+=Fe2++2Fe3++4H2O(3分)
(4)4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+ O2↑(3分)
(5)45(2分);56(2分)
解析试题分析:本题突破点在与B在常温下是无色液体,故B为谁,C为淡黄色固体,能与水反应生成G溶液与F气体单质,故C为Na2O2,G为NaOH,F为O2;L为红褐色固体,为Fe(OH)3,由D I溶液可知I为FeCl3,J为FeCl2,A为单质铁。从而可以推导出其他物质分别为:A为Fe,B为H2O,C为Na2O2,D为Fe3O4,E为H2,F为O2,G为NaOH,H为Na,I为FeCl3,J为FeCl2,K为NaCl。(1)单质A为金属Fe,在元素周期表的位置为第四周期Ⅷ族。(2)反应③为水与过氧化钠的反应,离子反应方程式为2Na2O2+2H2O=4NaOH+O2↑(3)反应④的反应为四氧化三铁和盐酸的反应,故离子反应方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O。(4)反应⑧为水与过氧化钠和氯化亚铁的反应,离子反应方程式为4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+ O2↑(5)反应②为电解水的反应,反应方程式为2H2O
I溶液可知I为FeCl3,J为FeCl2,A为单质铁。从而可以推导出其他物质分别为:A为Fe,B为H2O,C为Na2O2,D为Fe3O4,E为H2,F为O2,G为NaOH,H为Na,I为FeCl3,J为FeCl2,K为NaCl。(1)单质A为金属Fe,在元素周期表的位置为第四周期Ⅷ族。(2)反应③为水与过氧化钠的反应,离子反应方程式为2Na2O2+2H2O=4NaOH+O2↑(3)反应④的反应为四氧化三铁和盐酸的反应,故离子反应方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O。(4)反应⑧为水与过氧化钠和氯化亚铁的反应,离子反应方程式为4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+ O2↑(5)反应②为电解水的反应,反应方程式为2H2O 2H2↑+O2↑,当有3.01×1024个电子发生转移时有2.5mol水被电解,即有45g水被消耗。阴极生成的气体为氢气,且产生的氢气与电解水的物质的量相等,都为2.5mol。故转化成体积为22.4L/mol×2.5mol=56L。
2H2↑+O2↑,当有3.01×1024个电子发生转移时有2.5mol水被电解,即有45g水被消耗。阴极生成的气体为氢气,且产生的氢气与电解水的物质的量相等,都为2.5mol。故转化成体积为22.4L/mol×2.5mol=56L。
考点:无机推断,离子反应方程式书写

有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、Fe2+、AlO2-、CO32-、NH4+、SO42-、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
| 实验内容以及现象 | 结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 | N中不含 离子 |
| ② | 确定M溶液中含有Na+,不含K+ |
 ③用pH试纸检测M溶液,pH试纸呈蓝色 ③用pH试纸检测M溶液,pH试纸呈蓝色 | |
NO3-存在于________溶液中,理由是____________________________________;
Cl-存在于________溶液中,是根据_________________ 确定的。
(3)根据(1)中的实验确定,M溶液中含有的离子为________________________。
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2

 Cr2O72-
Cr2O72-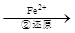 Cr3+
Cr3+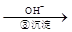 Cr(OH)3↓
Cr(OH)3↓ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O