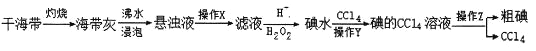题目内容
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) ![]() I3-(aq)△H。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq)△H。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是

A. 该反应△H<0
B. 若在T1、T2温度下,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I3-)大
【答案】C
【解析】
A.随着温度升高,I-的浓度逐渐增大,说明升高温度,化学平衡逆向移动,逆反应为吸热反应,则I2(aq)+I-(aq) ![]() I3-(aq) 正反应为放热反应,△H<0,A正确;
I3-(aq) 正反应为放热反应,△H<0,A正确;
B.因为K=![]() ,T2>T1,所以当温度升高时,反应向逆方向移动,即K1>K2,B正确;
,T2>T1,所以当温度升高时,反应向逆方向移动,即K1>K2,B正确;
C.从图中可以看出D点并没有达到平衡状态,c(I-)小于该温度下的平衡浓度,所以反应逆向进行,故v逆>v正, C错误;
D.温度T2>T1,升高温度,平衡逆向移动,c(I3-)变小,所以c(I3-): A>B,即状态A的c(I3-)高, D正确;
故合理选项是C。

练习册系列答案
相关题目