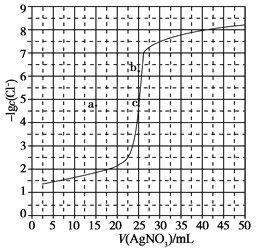
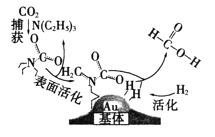
题目内容
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是

A.HA的电离平衡常数Ka=10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.点④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
【答案】C
【解析】
A. HA的电离平衡常数Ka=![]() =10-5,A正确;
=10-5,A正确;
B. 点①所示的溶液,n(NaA)=n(HA),2n(Na+)= n(A-)+ n(HA),所以2c(Na+)=c(A-)+c(HA),B正确;
C. 点③所示的溶液中,HA与NaOH刚好完全反应,此时溶质为NaA在溶液中存在以下两个平衡:A-+H2O![]() HA+OH- ,H2O
HA+OH- ,H2O![]() H++OH-,c(HA)=c(OH-)-c(H+),C错误;
H++OH-,c(HA)=c(OH-)-c(H+),C错误;
D. 点④所示的溶液中n(NaA)=0.002mol,n(NaOH)=0.001mol,溶液中存在以下两个平衡:
A-+H2O![]() HA+OH- H2O
HA+OH- H2O![]() H++OH-
H++OH-
0.002-x x 0.001+x y y
2n(OH-)-2n(H+)=0.002+2x
n(A-)+3n(HA)=0.002-x+3x=0.002+2x
同一混合溶液,体积相同,所以有2c(OH-)-2c(H+)=c(A-)+3c(HA),D正确。
故选C。

【题目】下表是有关物质的Ksp:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
Ksp(单位省略) | 2.8×10-9 | 6.8×10-6 | 4.7×10-6 | 5.6×10-12 |
回答下列问题:
(1)___(填“能”或“不能”)直接把贝壳研磨成粉末撒入海水中,使Mg2+转化为MgCO3沉淀,原因是_______。
(2)实际生产中是把Mg2+转化为Mg(OH)2沉淀,而不是转化为MgCO3沉淀,原因是______,请你推测应将贝壳进行怎样的加工处理_____。
(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他_____(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是__________。
(4)要制得无水MgCl2,过滤出Mg(OH)2沉淀后,用试剂_____(填化学式)将其溶解,选择该试剂的理由是__________。
(5)将得到的氯化镁溶液在浓缩池中制得MgCl2·6H2O。然后将MgCl2·6H2O转移到干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,原因是_______。