题目内容
9.下表为元素周期表的一部分,元素①~⑦在表中的位置如下所示:
请用元素符号或化学式回答下列问题.
(1)⑤的元素符号是Si,其最高正价是+4;
(2)①~⑦中金属性最强的是Na,能证明⑥比②的非金属性强的事实是H2SO4为强酸、H2CO3为弱酸;
(3)①、③形成的化合物是HO2或H2O2;
(4)④、⑥、⑦原子半径由大到小的顺序是Na>S>Cl;④的最高价氧化物的水化物是NaOH,它与⑥的最高价含氧酸反应的离子方程式是H++OH-=H2O.
分析 由元素在周期表中位置,可知①为H、②为C、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl,
(1)⑤为Si元素,其最高正价为+4;
(2)根据同一主族,原子序数越大,金属性越强,同一周期中,原子序数越大,金属性越弱进行判断;
(3)氢和氧元素可以形成水和双氧水;
(4)同一周期中,原子序数越大,原子半径越小;④的最高价氧化物的水化物是氢氧化钠;⑥的最高价含氧酸为硫酸,硫酸与氢氧化钠反应生成硫酸钠和水.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl,
(1)⑤为硅元素,元素符号为:Si,硅的最外层含有4个电子,其最高正化合价为+4,
故答案为:Si;+4;
(2)①~⑦中金属性最强的是Na元素;⑥为S、②为C,由于H2SO4为强酸、H2CO3为弱酸,则S的非金属性比C强,
故答案为:Na;H2SO4为强酸、H2CO3为弱酸(合理即可);
(3)①、③分别为H、O元素,二者形成的化合物为:H2O、H2O2,
故答案为:H2O;H2O2;
(4)Na、S和Cl位于同一周期,原子序数越大,原子半径越小,则原子半径大小为:Na>S>Cl;
④为Na,其最高价氧化物的水化物是NaOH;⑥的最高价含氧酸为硫酸,硫酸与氢氧化钠反应生成硫酸钠和水,反应的离子方程式为:H++OH-=H2O,
故答案为:Na>S>Cl;NaOH;H++OH-=H2O.
点评 本题考查了元素周期表和元素周期律的综合应用,题目难度中等,熟练掌握原子结构与元素周期表、元素周期律的关系为解答关键,试题侧重考查学生的分析、理解能力及灵活应用 基础知识的能力.

练习册系列答案
相关题目
19.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应:
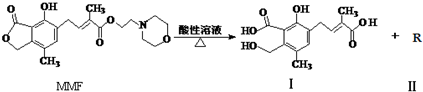
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1molMMF与足量NaOH 溶液共热,最多可消耗5molNaOH | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物 R的分子式为C6H13NO2 | |
| D. | 一个MMF分子中含有2个手性碳原子 |
20.下列各组中,互为同素异形体的是( )
| A. | 12H2和13H2 | B. | H2O与H2O2 | C. | 金刚石和石墨 | D. | 碘晶体和碘蒸气 |
17.“西气东输”是我国为改善东部地区能源紧缺、开发大西北而实施的一项重大工程.这里的“气”是指( )
| A. | 氢气 | B. | 天然气 | C. | 一氧化碳 | D. | 水煤气 |
4.银锌纽扣电池放电时的反应为Zn+Ag2O═ZnO+2Ag,该电池的负极是( )
| A. | Zn | B. | Ag2O | C. | ZnO | D. | Ag |
1.下列说法中正确的是( )
| A. | 已知BF3键角为120°,则SnBr2键角小于120° | |
| B. | SO2是直线型分子 | |
| C. | PCl5是三角锥形分子 | |
| D. | 四氨合铜离子中铜离子的配位数为2 |
18.下列物质能用铝制器皿盛放的是( )
| A. | 稀硝酸 | B. | 稀硫酸 | C. | 浓硝酸 | D. | 浓盐酸 |
19.图所示装置中,已知电子由b极沿导线流向锌.下列判断正确的是( )
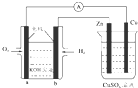

| A. | 该装置中Zn极为阳极 | |
| B. | 一段时间后铜片上质量增加 | |
| C. | a极反应的电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 当铜极的质量变化为32g时,b极上消耗的O2的体积为11.2 L |
