题目内容
【题目】联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下:
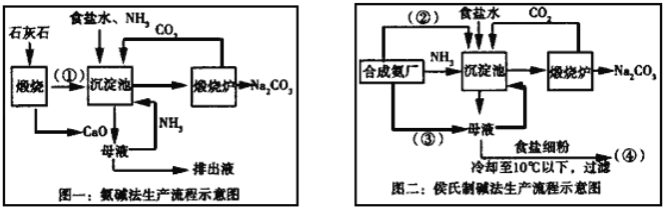
完成下列填空:
(1)写出化学式:②_____、③____
(2)从理论上分析,氨碱法生产过程中_____(选填“需要”、“不需要”)补充氨气,写出该工艺中生成CaCl2的化学方程式________________。
(3)对联碱法中从母液中提取氯化铵晶体的过程进行分析,所得结论合理的是______。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气可把碳酸氢钠转化为碳酸钠,防止碳酸氢钠析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(4)取“侯氏制碱法”生产的纯碱样品5.500g,配成500mL溶液,取25mL溶液用0.1000mol/L的标准盐酸滴定(设其中的杂质不与盐酸反应),用酚酞作指示剂,三次滴定消耗盐酸的平均量为25.00mL.计算样品中纯碱的质量分数______。(已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3)某活动小组根据上述制碱原理,用如下所示装置(夹持装置省略)制备碳酸氢钠.
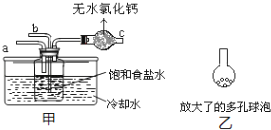
(5)实验时,须先从____管通入_____气体,再从_____管中通入_____气体。
(6)有同学建议在甲装置的b管下端连接乙装置,目的是________________________________。
【答案】CO2 NH3 不需要 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O b 96.4% a 氨气 b 二氧化碳 增大二氧化碳与溶液接触面积,使其充分反应
【解析】
(1)根据流程图分析;
(2)氨碱法生产过程中,母液中加入氧化钙反应生成的氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用;氢氧化钙与氯化铵反应生成氯化钙、氨气和水;
(3)根据母液中通入氨气、食盐会析出氯化铵晶体进行分析;
(4)用酚酞作指示剂,盐酸滴定碳酸钠溶液,根据反应方程式计算;
(5)通氨气时要防止倒吸,则导管不能直接深入液面以下,由于二氧化碳的溶解度较小,要先通氨气;
(5)多孔球泡能增大二氧化碳与溶液的接触面积。
(1)联碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,所以通入沉淀池中的是二氧化碳,即②为CO2,母液中通入氨气再重新利用,则③为NH3;
(2)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;
CaO与水反应生成氢氧化钙,氢氧化钙与氯化铵反应生成氯化钙,则该工艺中生成CaCl2的化学方程式Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;
(3)a.常温时氯化铵的溶解度比氯化钠大,故a错误;
b.通氨气能增大NH4+的浓度,使NH4Cl更多地析出,使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;
c.加入食盐细粉目的是提高Cl﹣的浓度,促进氯化铵结晶析出,故c错误;
(4)已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3,则用酚酞作指示剂滴定时,发生的反应为Na2CO3+HCl=NaHCO3+NaCl,
则n(Na2CO3)=0.1000mol/L×0.025L×![]() =0.05mol,
=0.05mol,
m(Na2CO3)=nM=0.05mol×106g/mol=5.3g,
样品中纯碱的质量分数:![]() ×100%=96.4%;
×100%=96.4%;
(5)向溶液中通氨气时要防止倒吸,则导管不能直接深入液面以下,由于二氧化碳的溶解度较小,要先通氨气,则先由a管通入氨气,再由通入二氧化碳;
(6)在甲装置的b管下端连接多孔球泡,能增大二氧化碳与溶液的接触面积,使二氧化碳充分溶解。

 考前必练系列答案
考前必练系列答案【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.AB.BC.CD.D