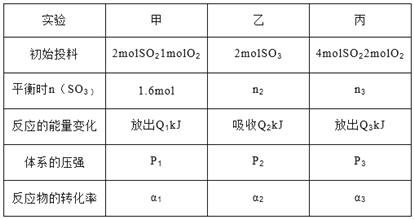
题目内容
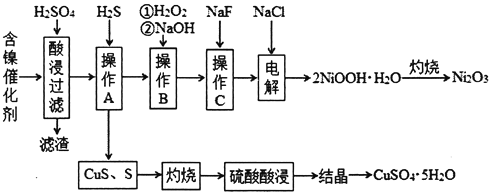
【题目】某科研小组以废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)为原料制取Ni2O3,工艺流程如下图:
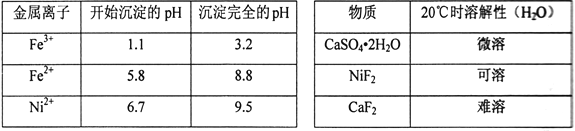
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
回答下列问题:
(1)滤渣的主要成分为BaSO4和____________________(填化学式)。
(2)操作A中发生反应的离子方程式为Cu2++H2S=CuS↓+2H+、_________________________;操作A中没有FeS和NiS沉淀产生,其原因是(用Ka和Ksp解释)__________________________。
(3)操作B加入H2O2的目的是________________,加NaOH溶液调节pH应在____________范围内;操作C中加入NaF的目的是____________________。
(4)该工艺流程中使用H2S气体,优点是可以制取副产品CuSO4·5H2O,但也有明显的缺点:一是产生空气污染,二是______________________________________________。
(5)电解产生2NiOOH·H2O的原理为:在碱性条件下电解,Cl-在阳极被氧化为ClO-,ClO-再将Ni2+氧化成2NiOOH·H2O沉淀。则阳极的电极反应式为________________________。
(6)0.80g CuSO4·5H2O副产品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,CuSO4·5H2O稳定存在的温度应低于________,则200℃时固体物质的化学式____________。

【答案】 CaSO42H2O 2Fe3++H2S=2Fe2++2H++S↓ 由Ka2=[S2-][H+]/[HS-]知:若溶液中c(H+)过大,则c(S2-)过小,达不到FeS和NiS沉淀的溶度积 将Fe2+氧化成Fe3+,有利于转化成Fe(OH)3沉淀 3.2≤pH<6.7 将Ca2+转化成CaF2沉淀 产生更多的Fe2+和H+,将消耗更多的氧化剂(H2O2)和NaOH Cl-+2OH--2e-=ClO-+H2O 102℃ CuSO4H2O
【解析】(1)由题目已知CaSO42H2O微溶,原料中含有一定量的CaO,加入硫酸酸浸,所以应该有CaSO42H2O析出。
(2)操作A的生成物中有单质S,只能是溶液中的Fe3+将通入的H2S氧化为单质S,方程式为:2Fe3++H2S=2Fe2++2H++S↓。注意:H2S是弱酸,不能拆分。上一步酸浸中硫酸应该过量,这一步通入H2S,H2S本来就是一个二元弱酸电离能力较差(Ka很小),上一步过量的氢离子对其电离又起到了抑制作用,所以溶液中的S2-的浓度应该很小。此时如果要形成硫化物沉淀,就要求该硫化物的KSP极小,本题中FeS和NiS的KSP较大,无法沉淀。
(3)加入过氧化氢的目的是为了将Fe2+氧化为Fe3+,以利于转化为氢氧化铁的沉淀除去。此时应该控制的pH是3.2到6.7之间(保证Fe3+沉淀完全,同时不沉淀Ni2+)。由题目已知,CaF2是难溶物,所以加入NaF是为了除去溶液中剩余的少量Ca2+。
(4)使用H2S气体,发生反应:2Fe3++H2S=2Fe2++2H++S↓,下一步中又要将Fe2+氧化为Fe3+,所以这个过程会增加需要加入的过氧化氢的量。同时反应生成H+会导致后续沉淀氢氧化铁的时候需要加入更多的氢氧化钠。
(5)阳极产生的是ClO-(ClO-再将Ni2+氧化成2NiOOH·H2O沉淀,是在溶液中进行的,不是电极反应),所以应该是Cl失去电子转化为ClO-,方程式为:Cl-+2OH--2e-=ClO-+H2O。
(6)图中102℃的时候固体质量开始下降,所以说明102℃时,CuSO4·5H2O开始分解,所以CuSO4·5H2O稳定存在的温度应低于102℃。图示中,200℃时,固体由0.8g降低为0.57g,减少0.23g。0.8gCuSO4·5H2O中含有的结晶水为0.288g,所以此时失去的都是结晶水,减少0.23g水,物质的量为0.0128mol,0.8gCuSO4·5H2O的物质的量为0.0032mol,其中含水为0.0032×5=0.016mol,所以200℃的时候剩余的结晶水为0.016-0.0128=0.0032mol,硫酸铜为0.0032mol,所以该化合物为:CuSO4H2O。

 阶梯计算系列答案
阶梯计算系列答案