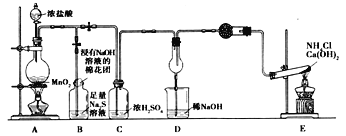
题目内容
【题目】已知:①I2(g)+H2(g)![]() 2HI(g)+26.5kJ、②I2(s)+H2(g)
2HI(g)+26.5kJ、②I2(s)+H2(g)![]() 2HI(g)-9.5kJ,下列分析正确的是
2HI(g)-9.5kJ,下列分析正确的是
A.①是放热反应,无需加热即可发生
B.②需持续不断加热才能发生反应
C.I2(g)和I2(s)的能量关系如图所示
D.1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量高
【答案】B
【解析】
A.虽然①是放热反应,但需加热引发发生,A不正确;
B.反应②为吸热反应,所以需持续不断加热才能发生反应,B正确;
C.利用盖斯定律,将①-②得:I2(g)![]() I2(s)+36.0kJ,I2(g)的能量应比I2(s)的能量高36.0kJ/mol,C不正确;
I2(s)+36.0kJ,I2(g)的能量应比I2(s)的能量高36.0kJ/mol,C不正确;
D.由②I2(s)+H2(g)![]() 2HI(g)-9.5kJ知,1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量低,D不正确;
2HI(g)-9.5kJ知,1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量低,D不正确;
故选B。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目