��Ŀ����
����Ŀ�������Dzⶨij��Ѫ����FeSO47H2O������Ԫ�غ���������ͼ�������������������գ�
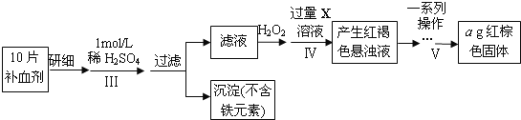
(1)�������Ҫ100mL1mol/L��ϡ���ᣬ��98.3%����=1.84g/cm3��Ũ�������ƣ����õIJ�����������Ͳ���ձ�����ͷ�ιܡ�_________��__________��H2O2��������_____________��
(2)�����һϵ�в��������ǣ��ٹ��ˢ�ϴ�Ӣ�_________����ȴ�ݳ������ز�����������Ŀ����____________________��֤���������Ƿ�ϴ�Ӹɾ��IJ���________________��
(3)����ʵ������ģ���ÿƬ��Ѫ������Ԫ�ص�����________g(�ú�a�Ĵ���ʽ��ʾ)��
���𰸡������� 100mL����ƿ ����Fe2+��ͬʱ������������ ���� ȷ������������ȫ�ֽ���������� ȡ���һ��ϴ��Һ�������еμ�BaCl2��Һ����������������ϴ�Ӹɾ� 0.07a
��������
(1)����100mLһ�����ʵ���Ũ�ȵ���ҺҪ�õ��������в�����������Ͳ���ձ�����ͷ�ιܡ���������100mL����ƿ��H2O2����ɫ���������ɽ�Fe2+����ΪFe3+��ͬʱ�������������ӣ�
(2)����V���յõ����������壬���������Ϊ���ˡ�ϴ�ӡ����ա���ȴ�����������ء�
(3)�ȼ���Fe2O3��FeԪ�صĺ�����Ȼ�������Ʒ������ag�ɼ���agFe2O3��FeԪ������Ϊ0.7ag������Ԫ���غ㣬1Ƭ��Ѫ������Ԫ������Ϊ0.07ag��
(1) ��98.3%����=1.84g/cm3��Ũ��������100mL1mol/L��ϡ������Ҫ�õ��IJ����������õ��������в�����������Ͳ���ձ�����ͷ�ιܡ���������100mL����ƿ��H2O2����ɫ���������ɽ�Fe2+����ΪFe3+��H2O2��õ��ӣ�����ԭΪH2O���������������ӣ�
(2)�ⶨij��Ѫ��(FeSO47H2O)����Ԫ�غ����������ܽ⣬������Fe2+ˮ�⣬Ȼ�����H2O2��Fe2+��ΪFe3+���������Һ�м������NaOH��Һ��ʹFe3+ת��ΪFe(OH)3����������Vһϵ�в��������ǣ��ٹ��ˢ�ϴ�Ӣ����բ���ȴ�ݳ������ز������������ز�����Ŀ����ȷ������������ȫ�ֽ������������֤���������Ƿ�ϴ�Ӹɾ��IJ������յõ����������壬(3)agFe2O3��FeԪ������Ϊ��ag��![]() =0.7ag������Ԫ���غ��֪��1Ƭ��Ѫ������Ԫ������Ϊ0.07ag��
=0.7ag������Ԫ���غ��֪��1Ƭ��Ѫ������Ԫ������Ϊ0.07ag��