题目内容
15.已知常温常压下:①3Cl2+2NH3→N2+6HCl,②3Cl2+8NH3→N2+6NH4Cl(1)完成并配平反应③的化学方程式,并标出电子转移方向和数目:③3Cl2+4NH3→

(2)在反应③中:还原剂是NH3,还原产物是NH4Cl 和HCl.
(3)若按③反应后产生气体4.48L(标准状况),则被氧化的气体的物质的量是0.08mol.
分析 (1)氧化还原中,得、失电子总数相等,进行配平,并用单线桥或者双线桥表示电子转移的方向和数目;
(2)根据化合价的升降判断还原剂和还原产物;
(3)生成的气体为氮气和氯化氢,二者物质的量之比为:1:4,可计算出氮气物质的量,氨气中的N元素被氧化为氮气,据此计算.
解答 解:(1)氯气具有强氧化性,氨气具有还原性,故氯气被还原为-1价,氨气中的N元素被氧化为0价,则可写出生成物为:N2、NH4Cl和HCl,由于已知:3Cl2+4NH3,观察法配平,得到:3Cl2+4NH3=N2+2NH4Cl+4HCl;氨气N元素失去6e-,氯气中Cl得到6e-,用单线桥表示电子转移方向和数目为: ,故答案为:
,故答案为: ;
;
(2)还原剂为化合价升高的反应物,氨气中N元素化合价升高,则氨气为还原剂;发生还原反应得到的产物为还原产物,即化合价降低的生成物,可知NH4Cl 和HCl中Cl元素化合价降低的元素,故还原产物为:NH4Cl 和HCl,故答案为:NH3;NH4Cl 和HCl;
(3)生成的气体为氮气和氯化氢,物质的量n==0.2mol,根据反应③可知,氮气与氯化氢体积比为1:4,即n(N2)=0.2mol×=0.04mol,根据2NH3→N2,即被氧化气体的物质的量为氮气物质的量的2倍,故被氧化气体物质的量为0.04mol×2=0.08mol,
故答案为:0.08.
点评 本题考查了查氧化还原反应,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,解答本题注意从质量守恒的角度判断生成物,题目难度中等.

练习册系列答案
相关题目
5.某有机物A 是农药生产中的一种中间体,其结构简式如图,下列叙述中正确的是( )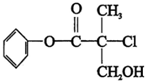

| A. | 有机物A 属于芳香烃 | |
| B. | 有机物A 可以与Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A 与浓硫酸混合加热,可以发生消去反应 | |
| D. | 有机物A 可与NaOH 溶液反应,生成多种可溶于水的化合物 |
6.减少酸雨产生的合理措施( )
①把工厂烟囱造高 ②燃料脱硫 ③开发洁净能源 ④在酸化土壤中加入石灰⑤用煤作燃料.
①把工厂烟囱造高 ②燃料脱硫 ③开发洁净能源 ④在酸化土壤中加入石灰⑤用煤作燃料.
| A. | ①②⑤ | B. | ①②③④ | C. | ②③ | D. | ②④⑤ |
3.下列说法正确的是( )
| A. | 侯德榜提出的联合制碱法可大大提高氯化钠的利用率 | |
| B. | 具有永久硬度的硬水可以采用加热的方法进行软化 | |
| C. | CO.CH4、CH3OH是一碳化学的主要原料 | |
| D. | 复合材料一般由起黏结作用的基体和起增强作用的增强体构成 | |
| E. | 油脂和氢氧化钠共热产生的混合物,加入食盐可使肥皂析出. |
10.下列关于Na2O2的说法正确的是( )
| A. | SO2和CO2都是酸性氧化物,SO2与Na2O2反应生成Na2SO3和O2 | |
| B. | 84 g NaHCO3受热分解,将生成的气体通过足量的Na2O2,固体质量增加31 g | |
| C. | 将Na2O2投入到酚酞试液中,溶液变红 | |
| D. | Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂 |
20.某元素质量数51,中子数27,其基态原子未成对电子数为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
7.向Fe(NO3)2溶液中加入少量稀盐酸,可能出现的现象是( )
| A. | 溶液由黄色变为浅绿色 | B. | 溶液由浅绿色变为黄色 | ||
| C. | 溶液由浅绿色变为血红色 | D. | 有气体产生 |
9.用FeCl3酸性溶液脱除H2S后的溶液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol•L-1的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):
(1)用KSCN溶液检验出Fe3+的现象是溶液变红.
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应:2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
①NaCl溶液的浓度是0.2mol•L-1.
②Ⅳ中检测Cl2的实验方法取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论(写出两点):通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl-放电.
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应:2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②Ⅳ中检测Cl2的实验方法取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论(写出两点):通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl-放电.
10.某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-.取200mL该溶液,分为等体积的二份分别做下列实验.实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL.实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克.下列说法正确的是( )
| A. | 该溶液中不一定含有Na+ | |
| B. | 该溶液中肯定含有NH4+、SO42-、CO32-、NO3- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含Na+,且c(Na+)≥0.1 mol/L |