题目内容
【题目】补铁剂常用于防治缺铁性贫血,其有效成分般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:
(1)能表示能量最低的亚铁离子的电子排布式是__(填标号)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是__,碳原子的杂化方式是__;琥珀酸亚铁中存在配位键,在该配位键中配位原子是__,中心原子是__。
(3)富马酸和马来酸互为顺反异构体,其电离常数如下表:
物质名称 | Ka1 | Ka2 |
富马酸( | 7.94×10-4 | 2.51×10-5 |
马来酸( | 1.23×10-2 | 4.68×10-7 |
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:__。
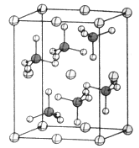
(4)β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a=870pm、b=680pm、c=479pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有__种空间取向,晶胞体内硫酸根离子的个数是__,铁原子周围最近的氧原子的个数为__;设阿伏加德罗常数的值为NA,则该晶体的密度是__g·cm-3(列出计算表达式)。
【答案】d 氧原子 sp2、sp3 氧原子 铁原子 马来酸中存在分子内氢键,提高了羧基的离子性,有利于酸性电离,因此马来酸电离主要以第一步电离为主 2 2 6 ![]()
【解析】
(1)基态铁原子核外电子排布式为[Ar]3d64s2,失去2个电子后变为亚铁离子,基态亚铁离子核外电子排布式为[Ar]3d6,因此能表示能量最低的亚铁离子的电子排布式是d;
(2)H、C、O中H元素电负性最小,C、O为同周期元素,原子序数越大,电负性越大,因此电负性最大的是O;C原子连接4个原子形成共价键时,C原子采用sp3杂化,C原子连接3个原子形成共价键时,C原子采用sp2杂化,因此丁二酸中碳原子的杂化方式为sp2、sp3;丁二酸中只有氧原子上有孤电子对,亚铁离子中存在空轨道,因此琥珀酸亚铁的配位键中配位原子为氧原子,中心原子为铁原子;
(3)马来酸中存在分子内氢键,提高了羧基的离子性,有利于酸性电离,因此一级电离较为容易,而剩余部分因为形成了分子内氢键而很稳定,相对难以电离,因此马来酸电离主要以第一步电离为主;
(4)该晶胞中,硫酸根离子在空间上的取向有: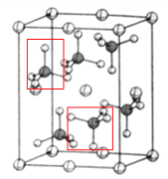 ,一共2种;β-硫酸亚铁的化学式为FeSO4,晶胞中含有亚铁离子数目为
,一共2种;β-硫酸亚铁的化学式为FeSO4,晶胞中含有亚铁离子数目为![]() ,则晶胞中所含硫酸根离子数目为4,从晶胞示意图中可以发现有6个硫酸根离子,其中有4个位于面上,故晶胞体内有2个硫酸根离子;以体心的亚铁离子为研究对象,每个硫酸根中均有一个氧原子离铁原子最近,亚铁离子周围最近的氧原子的个数为6;该晶体的密度
,则晶胞中所含硫酸根离子数目为4,从晶胞示意图中可以发现有6个硫酸根离子,其中有4个位于面上,故晶胞体内有2个硫酸根离子;以体心的亚铁离子为研究对象,每个硫酸根中均有一个氧原子离铁原子最近,亚铁离子周围最近的氧原子的个数为6;该晶体的密度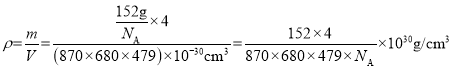 。
。

 一本好题口算题卡系列答案
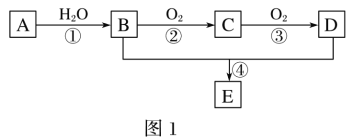
一本好题口算题卡系列答案【题目】纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。如图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:
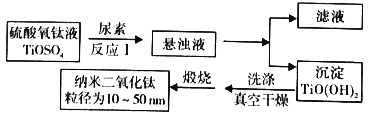
回答下列问题:
(1)反应1中发生两个反应,其一是尿素[CO(NH2)2]与H2O反应生成CO2和NH3·H2O,则另一反应的离子方程式为__。
(2)判断TiO(OH)2沉淀是否洗净的实验操作和现象是:__。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过__、__、__(填基本操作)即可回收__(填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米二氧化钛产率的影响,设计如下实验。
实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比n[CO(NH2)2]:n[TiO(OH)2] |
① | 90 | 1 | 2:1 |
② | 90 | 2 | 3:1 |
③ | 90 | 1 | |
④ | 110 | 2 | 3:1 |
实验②和④的实验目的是__,实验③中反应物物质的量配比为__。
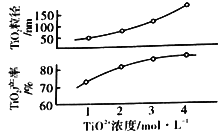
(5)反应Ⅰ中TiO2+浓度对TiO2的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的TiO2+浓度为__。