题目内容
【题目】下表是元素周期表的一部分,回答下列有关问题:
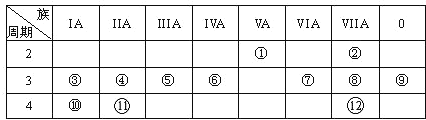
(1)写出下列元素符号:①______ ,⑥______,⑦______。
(2)画出原子的结构示意图:④________________,⑧_________________。
(3)在①~![]() 元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是_______(均填元素名称)。
元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是_______(均填元素名称)。
(4)元素③、⑩、![]() 的氢氧化物碱性由强到弱的顺序________________;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序______________________(均用化学式填空)。
的氢氧化物碱性由强到弱的顺序________________;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序______________________(均用化学式填空)。
【答案】N Si S ![]()
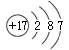 钾 氟 氩 KOH>Ca(OH)2>NaOH SiH4<H2S<HCl
钾 氟 氩 KOH>Ca(OH)2>NaOH SiH4<H2S<HCl
【解析】
根据元素在周期表中的位置确定各种元素,然后利用元素周期律分析解答,对各个问题逐一进行解答。
根据元素在周期表的相对位置可知:①是N,②是F,③是Na,④是Mg,⑤是Al,⑥是Si,⑦是S,⑧是Cl,⑨是Ar,⑩是K,![]() 是Ca,
是Ca,![]() 是Br元素。
是Br元素。
(1)根据上述分析可知:①是N,⑥是Si,⑦是S元素;
(2)④是Mg元素,原子序数是12,原子核外电子排布为2、8、2,其原子结构示意图是:![]() ;
;
⑧是Cl元素,原子序数是17,原子核外电子排布为2、8、7,其原子结构示意图是: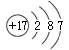 ;
;
(3)同一周期元素,原子序数越大,元素的金属性越弱,非金属性越强;同一主族元素,原子核外电子层数越多,原子越容易失去电子,元素的金属性越强,非金属性越弱,所以在上述元素中,金属性最强的元素是钾元素;非金属性最强的元素是氟元素;0族元素最外层满足2个电子(He)或8个电子的稳定结构,不容易失去电子,也不容易得到电子,化学性质最不活泼,故在上述元素中,最不活泼的元素是氩元素;
(4)由于同一周期元素,原子序数越大,元素的金属性越弱;同一主族元素,原子核外电子层数越多,元素的金属性越强。③是Na,⑩是K,![]() 是Ca,则元素的金属性由强到弱的顺序是:K>Ca>Na,元素的金属性越强,其最高价氧化物对应的水化物的碱性越强,所以这三种元素的氢氧化物的碱性由强到弱的顺序是:KOH>Ca(OH)2>NaOH;
是Ca,则元素的金属性由强到弱的顺序是:K>Ca>Na,元素的金属性越强,其最高价氧化物对应的水化物的碱性越强,所以这三种元素的氢氧化物的碱性由强到弱的顺序是:KOH>Ca(OH)2>NaOH;
由于同一周期的元素,原子序数越小,元素的非金属性越弱。⑥是Si,⑦是S,⑧是Cl,三种元素位于同一周期,则三种元素的非金属性由弱到强的顺序是:Si<S<Cl。元素的非金属性越弱,其相应的氢化物的稳定性就越弱,则这三种元素的氢化物的稳定性由弱到强的顺序是:SiH4<H2S<HCl。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】补铁剂常用于防治缺铁性贫血,其有效成分般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:
(1)能表示能量最低的亚铁离子的电子排布式是__(填标号)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
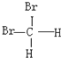
(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是__,碳原子的杂化方式是__;琥珀酸亚铁中存在配位键,在该配位键中配位原子是__,中心原子是__。
(3)富马酸和马来酸互为顺反异构体,其电离常数如下表:
物质名称 | Ka1 | Ka2 |
富马酸( | 7.94×10-4 | 2.51×10-5 |
马来酸( | 1.23×10-2 | 4.68×10-7 |
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:__。
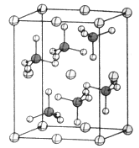
(4)β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a=870pm、b=680pm、c=479pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有__种空间取向,晶胞体内硫酸根离子的个数是__,铁原子周围最近的氧原子的个数为__;设阿伏加德罗常数的值为NA,则该晶体的密度是__g·cm-3(列出计算表达式)。