题目内容
【题目】下列说法不正确的是( )
A.化学反应的实质是旧键的断裂,新键的生成
B.CH4、CF4、CCl4、CBr4 熔、沸点逐渐升高,原因是分子间作用力逐渐增大
C.NH3 和 H2O 分子间都可以形成氢键
D.NH4H 是离子化合物,其含有离子键、极性键、非极性键
【答案】D
【解析】
A.化学反应的实质就是旧键的断裂,新键的生成,故A正确;
B.CH4、CF4、CCl4、CBr4均为分子晶体,其熔、沸点受分子间作用力的影响,结构相似的共价物质的分子间作用力与相对分子质量成正比,CH4、CF4、CCl4、CBr4相对分子质量依次增大,故分子间作用力逐渐增大,熔、沸点逐渐升高,故B正确;
C.氢键是指氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子Y(O 、F、 N等)接近,在X与Y之间以氢为媒介,生成X-H![]() Y形式的一种特殊的分子间或分子内相互作用,故NH3和H2O分子间都可以形成氢键,故C正确;
Y形式的一种特殊的分子间或分子内相互作用,故NH3和H2O分子间都可以形成氢键,故C正确;
D.NH4H是离子化合物,其含有离子键、极性键,但没有非极性键,故D错误;
故答案为:D。

 阅读快车系列答案
阅读快车系列答案【题目】室温下进行下列实验,根据实验操作和现象所得到的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向Na2SiO3溶液中通入CO2,产生白色沉淀 | 碳的非金属性比硅的强 |
B | 向3mLKI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | I-的还原性比Br-的强 |
C | 向溶液X中滴加KSCN溶液,无明显现象,再滴加新制氯水后溶液显红色 | X中一定含Fe2+ |
D | 向溶液Y中滴加BaCl2溶液,出现白色沉淀,再加入足量稀盐酸,沉淀不溶解 | Y中一定含 |
A.AB.BC.CD.D
【题目】补铁剂常用于防治缺铁性贫血,其有效成分般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:
(1)能表示能量最低的亚铁离子的电子排布式是__(填标号)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是__,碳原子的杂化方式是__;琥珀酸亚铁中存在配位键,在该配位键中配位原子是__,中心原子是__。
(3)富马酸和马来酸互为顺反异构体,其电离常数如下表:
物质名称 | Ka1 | Ka2 |
富马酸( | 7.94×10-4 | 2.51×10-5 |
马来酸( | 1.23×10-2 | 4.68×10-7 |
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:__。
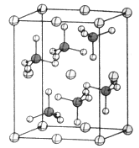
(4)β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a=870pm、b=680pm、c=479pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有__种空间取向,晶胞体内硫酸根离子的个数是__,铁原子周围最近的氧原子的个数为__;设阿伏加德罗常数的值为NA,则该晶体的密度是__g·cm-3(列出计算表达式)。