题目内容
【题目】工业上湿法制高铁酸钾的基本流程如下:
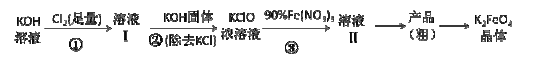
已知:高铁酸盐热稳定性差
回答下列问题:
(1)第③步发生反应的离子方程式 。
(2)第③步反应的体系,温度不宜过高,并最好控制温度在 30℃以下,其原因是 。
(3)通过结晶方法从溶液II得到的粗产品中主要含有杂质 (填化学式),可通过重结晶法提纯K2FeO4,具体操作步骤有:将粗产品先用饱和KOH溶液溶解,然后浓缩、冷却结晶、过滤、洗涤、干燥。其干燥可采用的方法是 (写出一种干燥方法)。
(4)利用电化学原理,用铁钉和氢氧化钾溶液为原料可以获得K2FeO4。在制备过程中铁钉作______极,请写出获得FeO42-的电极反应式 。
【答案】(1)2Fe3++3ClO-+10OH--===2FeO42-+3Cl-+5H2O(2分)
(2)防止生成的K2FeO4因受热而分解(1分)
(3)KNO3、KCl(2分),用无水乙醇(或者丙酮)洗涤带走固体表面的水分(2分)
(4)阳极,(1分)Fe–6e- +8OH- =FeO42- +4H2O (2分)
【解析】
试题分析:(1)根据流程图,第③步是铁离子与ClO-在碱性条件下发生氧化还原反应生成高铁酸根离子、Cl-和水,反应的离子方程式为2Fe3++3ClO-+10OH--===2FeO42-+3Cl-+5H2O。
(2)因为高铁酸盐热稳定性差,为防止生成的K2FeO4因受热而分解,所以在第③步反应的体系,温度不宜过高,并最好控制温度在 30℃以下。
(3)反应③的化学反应为2Fe(NO3)3+3KClO+10KOH===2K2FeO4+3KCl+5H2O+6KNO3,所以通过结晶方法从溶液II得到的粗产品中主要含有杂质为KNO3、KCl;因乙醇易挥发且和水互溶,所以干燥可采用的方法是用无水乙醇(或者丙酮)洗涤带走固体表面的水分。
(5)利用电化学原理,用铁钉和氢氧化钾溶液为原料可以获得K2FeO4,铁元素由0价升高到+6价,失电子发生氧化反应,所以在制备过程中铁钉作阳极,阳极生成FeO42-的电极反应式为Fe–6e- +8OH- =FeO42- +4H2O。