题目内容
14. (1)合成氨反应的热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.2kJ•mol-1
(1)合成氨反应的热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.2kJ•mol-1已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2kJ的热量,至少在反应混合物中要投放N2的物质的量为10 mol.
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时:正极的电极反应式:O2+4e-+2H2O═4OH-,负极的电极反应式:N2H4+4OH--4e-═4H2O+N2↑.
(3)如图是一个电解过程示意图.
①锌片上发生的电极反应式是:Cu2++2e-═Cu
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气112L(假设空气中氧气体积分数为20%;Cu相对原子质量:64).
分析 (1)反应热与化学计量数成正比,热化学方程式中的△H是指反应物完全转化时的△H;
(2)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气;
(3)①锌为阴极,发生还原反应生成铜;
②根据转移电子相等计算需要空气的体积.
解答 解:(1)在N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1反应中的△H是指1molN2(g)与3nolH2(g)完全转化为2molNH3(g)时放出的热量,要想通过该反应得到92.2kJ的热量,需要1molN2(g)参加反应,若2的转化率为10%,需加入的N2(g)的物质的量为$\frac{1mol}{0.1}$=10mol,
故答案为:10;
(2)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,正极发生还原反应,电极方程式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;N2H4+4OH--4e-=4H2O+N2↑;
(3)①锌为阴极,发生还原反应生成铜,电极方程式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
②电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=$\frac{128g}{64g/mol}$×2=4mol,
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=$\frac{\frac{4mol}{4}×22.4L/mol}{20%}$=112L,
故答案为:112.
点评 本题考查反应热与能量变化、原电池和电解池原理,侧重于考查学生的分析能力,注意把握题给信息,根据各个电极上得失电子书写电极反应,再结合电极反应式进行有关计算,题目难度中等.

| A. | 用酒精做萃取剂萃取碘水中的碘 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量Na2SO4 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用蒸馏的方法制取蒸馏水 |
| A. | 钠与冷水的反应 | |
| B. | 甲烷在氧气中的燃烧反应 | |
| C. | 灼热的木炭与CO2反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
| A. | CCl4的比例模型示意图为 | B. |  的名称为2,6-二甲基3乙基庚烷 的名称为2,6-二甲基3乙基庚烷 | ||
| C. | 化合物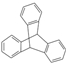 有4种一氯代物 有4种一氯代物 | D. | 1mol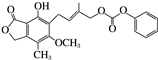 最多能与4molNaOH完全反应 最多能与4molNaOH完全反应 |
| A. | 碱性锌锰电池的负极是锌 | |
| B. | 在船身装锌块不属于牺牲阳极的阴极保护法 | |
| C. | 电解精炼铜时,杂质Fe、Zn、Ag等沉积在电解槽底部 | |
| D. | 钢铁发生吸氧腐蚀时,负极的电极反应式为 2H2O+O2+4e-═4OH- |
 现需配制0.4mol•L-1 NaOH 溶液480mL.某同学转移溶液的示意图如图:
现需配制0.4mol•L-1 NaOH 溶液480mL.某同学转移溶液的示意图如图: