题目内容
【题目】化学就在我们身边,它与我们的生活息息相关。
(1)现有H、C、Na、O、Ca六种元素,请选用其中的元素书写下列化学用语:
①可做食品干燥剂的氧化物__________ ;
②厨房中常用的酸__________________ ;
③侯氏制碱法制得的“碱”____________ ;
④含氧量最高的氧化物______________ 。
(2)铅蓄电池在生产、生活中使用广泛.其构造示意图如图,回答下列问题:
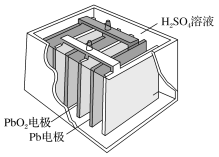
①铅蓄电池充电时是将电能转化为__________ 能。
②铅蓄电池放电过程中,反应的化学方程式为 Pb+PbO2+2H2SO4===2PbSO4+2H2O,据此可知,铅蓄电池在放电时,溶液的pH不断__________ (填“增大”、“减小”或“不变”)。
【答案】CaO CH3COOH Na2CO3 H2O2 化学 增大
【解析】
(1)①氧化钙为氧化物,能够与水反应,可以做食品干燥剂;②醋酸是厨房中常用的酸,调味品;③侯氏制碱法制得的“碱”为碳酸钠;④根据氧化物的分子组成,计算氧元素的百分含量。
(2)①根据铅蓄电池也是化学电池,在充电时,消耗电能,得到化学能解答。
②由铅蓄电池的总反应Pb+PbO2+2H2SO4═2PbSO4+2H2O可以知道,硫酸被消耗,所以酸性减弱,pH不断增大解答。
(1)①氧化钙为氧化物,能够与空气中的水反应,因此可做食品干燥剂;正确答案:CaO。
②醋酸显酸性,是厨房中常用的酸;正确答案:CH3COOH。
③氨气、二氧化碳、氯化钠三者共同作用生成氯化铵和碳酸氢钠,碳酸氢钠受热分解为碳酸钠,侯氏制碱法制得的“碱”为碳酸钠;正确答案:Na2CO3。
④在上述几种元素组成的H2O、H2O2、CO、CO2、Na2O2、Na2O、CaO氧化物中,含氧量最高的氧化物为H2O2;正确答案:H2O2。
(2)①铅蓄电池也是化学电池,在充电时,消耗电能,得到化学能,故充电时将电能转化为化学能;正确答案:化学。
②由铅蓄电池的总反应Pb+PbO2+2H2SO4═2PbSO4+2H2O,从中可以知道,硫酸被消耗,所以酸性减弱,pH不断增大;正确答案:增大。

【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
离子 | Na+ | Al3+ | Cl﹣ | X |
个数 | 2a | a | a | b |
A.NO3﹣、2a
B.SO42﹣、2a
C.OH﹣、2a
D.SO42﹣、4a
【题目】氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
(1)已知:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O |
键能(kJ/mol) | 497 | 803 | 1072 |
则反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=________kJ/mol。
N2(g)+2CO2(g) △H=________kJ/mol。
(2)在一定温度下,向体积为1L的密闭容器中充入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示。
N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示。
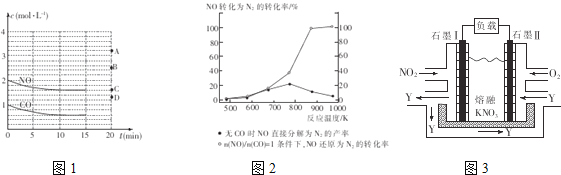
①该反应的平衡常数K的计算式为___________________;前10分钟内用氮气表示的反应速率为____________________。
②若保持温度不变,15分钟时再向该容器中充入1.6molNO、0.4molCO2,则此时反应的
ν正________ν逆(填“>”、“=”或“<”)。
③若保持其他条件不变,15min时压缩容器的体积至0.5L,20分钟时反应重新达到平衡,NO的浓度对应的点应是图1中的________(填字母)。
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因是_________________________________________。
Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的___极,石墨Ⅰ附近发生的反应电极反应式为______________________相同条件下,消耗的O2和 NO2的体积比为__________。
