题目内容
【题目】离子晶体是常见的晶体类型。请回答以下问题:
(1)离子晶体中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
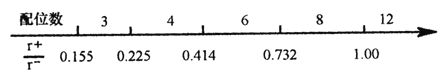
已知在某AB型离子化合物中,A+离子的半径为84pm,B-离子的半径为140pm。分析以上信息,与A+离子配位的所有B-离子,在空间构成的立体形状为_______。
(2)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为________ (填化学式),原因是________。
(3)向疏酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH2)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。该四配位离子的结构式为_______。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为__________。
(5)H和Mg能形成一种离子型储氢材料,晶体结构如右图所示:
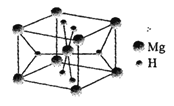
则该晶体中Mg的配位数是______,其化学式为________。已知该晶体的密度为ρg·cm-3,晶胞的体积为__________(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
【答案】 正八面体 Cu2O 氧离子半径小于硫离子半径,Cu2O的晶格能大于Cu2S 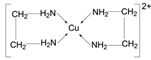 100% 6 MgH2
100% 6 MgH2 ![]()
![]()
【解析】(1) 在AB中,A+离子的半径为84pm,B-离子的半径为140pm,![]() ,从题给图中可知配位数为6,与氯化钠相同,已知NaCl中阴离子周围的6个阳离子在空间围成的立体形状为正八面体,同理AB晶体中与阴离子配位的6个阳离子在空间构成的立体形状为正八面体;(2) 因为氧离子半径小于硫离子半径,所以Cu2O的晶格能大于Cu2S,因此氧化亚铜的熔点比硫化亚铜的高;(3) 乙二胺(H2N-CH2-CH2-NH2)中N有孤电子对,Cu2+提供空轨道,根据信息每个Cu2+可与两个形成四配位离子,结构式为
,从题给图中可知配位数为6,与氯化钠相同,已知NaCl中阴离子周围的6个阳离子在空间围成的立体形状为正八面体,同理AB晶体中与阴离子配位的6个阳离子在空间构成的立体形状为正八面体;(2) 因为氧离子半径小于硫离子半径,所以Cu2O的晶格能大于Cu2S,因此氧化亚铜的熔点比硫化亚铜的高;(3) 乙二胺(H2N-CH2-CH2-NH2)中N有孤电子对,Cu2+提供空轨道,根据信息每个Cu2+可与两个形成四配位离子,结构式为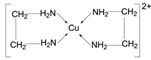 ;(4) C603-堆积方式为面心立方结构,位于顶点和面心,个数为8
;(4) C603-堆积方式为面心立方结构,位于顶点和面心,个数为8![]() ,根据化学式K3C60,K+的个数为12,K+位于空隙中,晶胞中被占据的空隙百分比为100%;(5)根据晶胞体心中的Mg原子可知,Mg的配位数是6;根据均摊法计算,晶胞中有8
,根据化学式K3C60,K+的个数为12,K+位于空隙中,晶胞中被占据的空隙百分比为100%;(5)根据晶胞体心中的Mg原子可知,Mg的配位数是6;根据均摊法计算,晶胞中有8![]() 个Mg,4
个Mg,4![]() 个H,故其化学式为MgH2;已知该晶体的密度为ρg·cm-3,晶胞的体积为V=
个H,故其化学式为MgH2;已知该晶体的密度为ρg·cm-3,晶胞的体积为V=![]() =
=![]() 。
。