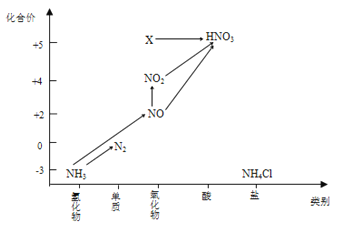
题目内容
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO![]() 、CO
、CO![]() 、SO
、SO![]() 、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是

A. 原溶液中一定只存在![]() 、
、![]() 、
、![]() 、Cl-四种离子
、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH===Al(OH)3↓
【答案】C
【解析】
某溶液加入过量的盐酸后产生气体,说明有碳酸根离子,则钡离子铁离子和铜离子都不存在,溶液A加入过量的氨水产生白色沉淀,则说明原溶液中有偏铝酸根离子,沉淀为氢氧化铝,滤液B加入过量的氢氧化钡产生白色沉淀,说明原溶液中有硫酸根离子,滤液C加入过量的稀硝酸和硝酸银,产生白色沉淀,因为最初加入盐酸,不能说明原溶液中是否有氯离子。
A.通过分析可知,原溶液中一定有偏铝酸根离子,碳酸根离子,硫酸根离子,钠离子,不能确定氯离子,故错误;
B.气体A的化学式是CO2,其电子式为![]() ,故错误;
,故错误;
C.通过分析可知原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+,故正确;
D.生成沉淀B的离子方程式为:Al3++3NH3H2O===Al(OH)3↓+3NH4+,故错误。
正确选项C。

【题目】A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第_______周期_______族;C元素和F元素的电负性比较,较小的是________。
(2)D的单质在空气中燃烧时火焰的颜色是__________________,请用原子结构的知识解释发光的原因:__________________________。
(3)H元素位于元素周期表的_________区。基态E原子的L层电子排布图为__________。
(4)B元素与宇宙中含量最丰富的元素形成的最简单化合物的VSEPR模型为________,B元素与同周期相邻两元素的电离能大小关系为______________ , 请解释原因__________________________________。
(5)G元素的低价阳离子的离子结构示意图是________,F元素原子的价电子的电子排布图是________。
(6)在基态G中,电子占据的最高能层符号为________,该能层具有的原子轨道数为____________。
(7)G的高价阳离子的溶液与H单质反应的离子方程式为___________________________;
(8)与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:________________________。