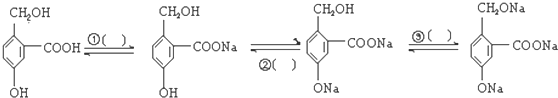
题目内容
5.已知A、B、C、D、E五种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;C与B、D均相邻;A、C、D三种元素的原子序数之和为25;E的基态价电子排布式为3d64s2.请回答下列问题:(1)比较B与C的电负性:B<C(填“>”、“<”或“=”);
(2)一定条件下,D的最高价氧化物对应水化物的浓溶液与E的单质发生反应的方程式2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O
(3)C和D两元素形成的氢化物的熔点存在较大的差异,其原因是水分子之间不仅存在分子间作用力,而且还存在着氢键.
(4)由A、B、C三元素以原子个数之比为4:2:3形成的化合物是离子晶体,所含化学键的类型是离子键、共价键.
分析 已知A、B、C、D、E五种元素,它们的原子序数依次增大.A在所有元素中原子半径最小,则A为H元素;A、C、D三种元素的原子序数之和为25,则C、D原子序数之和为25-1=24,C与B、D均相邻,则C、D只能同主族,可推知C为O元素、D为S元素,则B为N元素;E的基态价电子排布式为3d64s2,则E为Fe,据此解答.
解答 解:已知A、B、C、D、E五种元素,它们的原子序数依次增大.A在所有元素中原子半径最小,则A为H元素;A、C、D三种元素的原子序数之和为25,则C、D原子序数之和为25-1=24,C与B、D均相邻,则C、D只能同主族,可推知C为O元素、D为S元素,则B为N元素;E的基态价电子排布式为3d64s2,则E为Fe.
(1)同周期随原子序数增大,电负性增大,故电负性N<O,故答案为:<;
(2)D的最高价氧化物对应水化物为硫酸,Fe与浓硫酸在加热条件下反应生成硫酸铁、二氧化硫与水,反应方程式为2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,
故答案为:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O;
(3)C和D两元素形成的氢化物分别为水、硫化氢,水分子之间不仅存在分子间作用力,而且还存在着氢键,二者的熔点存在较大的差异,
故答案为:水分子之间不仅存在分子间作用力,而且还存在着氢键;
(4)由H、N、O三元素以原子个数之比为4:2:3形成的化合物是 NH4NO3,属于离子晶体,含有离子键、共价键,故答案为:离子;离子键、共价键.
点评 本题考查位置结构性质关系应用,明确元素种类是解题关键,注意对基础知识的理解掌握.

 口算能手系列答案
口算能手系列答案| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑪ |
(2)金属性最强的单质与水反应的化学方程式为:2K+2H2O═2KOH+H2↑①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH(写化学式).
(3)某元素的最高价氧化物的水化物既能与强酸反应生成盐A和水又能与强碱反应生成盐B与水,写出盐B溶液与小苏打溶液反应的离子方程式AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为:随着氢氧化钠的滴入,白色沉淀逐渐增加,当达到最多后又逐渐减少,最后完全消失,得到澄清溶液.
| A. | 燃烧、酸碱中和反应都是放热反应 | |
| B. | 化学反应必然伴随着能量的变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子半径小于氧原子 |
| B | 干冰的熔沸点低 | 干冰为分子晶体 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
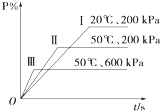 在一密闭容器中进行以下可逆反应:M(g)+P(g)═N(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )
在一密闭容器中进行以下可逆反应:M(g)+P(g)═N(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )| A. | 正反应放热,L是固体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应吸热,L是固态 | D. | 正反应放热,L是固体或气体 |
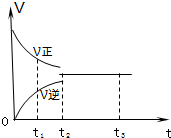 如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应没有逆方向反应 | |
| B. | t2时,反应已达到平衡状态 | |
| C. | t2-t3,各物质的浓度不再发生变化 | |
| D. | t2-t3,处于静止状态,反应不再发生 |
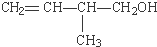 的键线式
的键线式