题目内容
【题目】重要化工原料CuSO4的制备途径及性质如图所示。下列说法错误的是

A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. Y物质具有还原性,可以是葡萄糖
D. 1molCuSO4在1100℃所得混合气体X中O2一定为0.75mol
【答案】D
【解析】A.Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,故A正确;
B.相对于途径①、③,途径②的优点:制取等质量胆矾需要的硫酸少、途径2无污染性气体产生,故B正确;
C、葡萄糖与氢氧化铜反应的方程式为:C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,所以Y可为葡萄糖,故C正确;
D、根据2CuSO4═Cu2O+SO2↑+SO3↑+O2↑知,1molCuSO4在1100℃所得混合气体X中O2为0.5mol,故D错误;

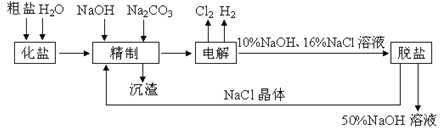
【题目】氯碱厂电解饱和食盐水制取NaOH的化学反应方程式为:2NaCl + H2O![]() 2NaOH + H2↑+ Cl2↑,工艺流程示意图如下:
2NaOH + H2↑+ Cl2↑,工艺流程示意图如下:
下表是NaCl和MaOH在水中的溶解度
温度 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
NaCl | 35.7g | 36g | 36.6g | 37.3g | 38.4g | 39.8g |
NaOH | 42g | 109g | 129g | 174g | 314g | 347g |
依据示意图和表,完成下列填空:
(1)工业食盐中含CaCl2、MgCl2等杂质。除去Ca2+、Mg2+过程发生反应的化学反应方程式为_____。
(2)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______、冷却、______(填写操作名称)除去NaCl。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________(填字母序号)。
①Ba(NO3)2 ②BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_______(少选多选都不计分)。
A.先加NaOH,后加Na2CO3,再加钡试剂 B.先加Na2CO3,后加钡试剂,再加NaOH
C.先加钡试剂,后加NaOH,再加Na2CO3 D.先加NaOH,后加钡试剂,再加Na2CO3
(5)用制得的 NaOH固体配制 240 mL0.2mol/L NaOH 溶液。
①配制时,必須使用的玻璃仪器有______________________。
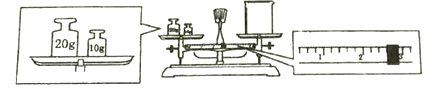
②某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。
烧杯的实际质量为________________g。
③在配制过程中,其他操作都是正确的,下列情对所配制的NaOH珩液的浓度偏高有_____。
A.没有洗涤烧杯和玻璃棒 B.容量瓶不干燥,含有少量蒸馏水
C.定容时俯视刻度线 D.定容时仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
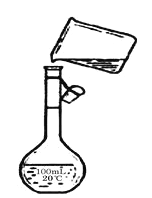
④下图是该同学转移溶液的示意图,图中的错误是_____________。