题目内容
【题目】
对甲苯丙烯酸甲酯 (E)是一种用于合成抗血栓药的中间体,其合成路线如下:
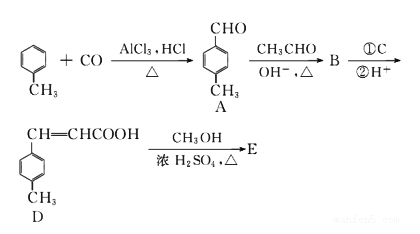
已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)A中官能团的名称为_______,A分子中核磁共振氢谱各峰值比为________。
(2)物质B的结构简式为_______,生成E的反应类型为__________。
(3)试剂C可选用下列中的_________。
a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(4)![]() 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________。
(5)遇FeCl 3溶液显紫色,且苯环上有两个取代基的A的同分异构体有______种,E在一定条件下可以生成高聚物F,F的结构简式为__________。
【答案】 醛基 1 : 2 : 2 : 3 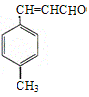 取代反应(或酯化反应) b、d
取代反应(或酯化反应) b、d 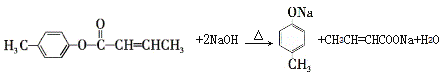 3
3 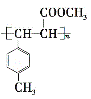
【解析】由合成路线可知,甲苯发生取代反应生成对甲基苯甲醛,再与CH3CHO在碱性条件下反应生成B,B为: 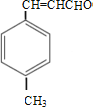 ,①中-CHO被弱氧化剂氧化为-COOH,而C=C不能被氧化,再酸化得到D:
,①中-CHO被弱氧化剂氧化为-COOH,而C=C不能被氧化,再酸化得到D: 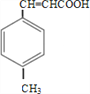 , D与甲醇发生酯化反应生成E为:
, D与甲醇发生酯化反应生成E为: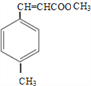 。
。
(1)A为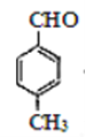 ,含有的官能团是醛基,它的等效氢在醛基上为一种,苯环是有二种,甲基是有一种,核磁共振氢谱各峰值比1 : 2 : 2 : 3。
,含有的官能团是醛基,它的等效氢在醛基上为一种,苯环是有二种,甲基是有一种,核磁共振氢谱各峰值比1 : 2 : 2 : 3。
(2)B为 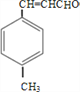 ,生成E的反应类型为 酯化反应(取代反应)。
,生成E的反应类型为 酯化反应(取代反应)。
(3)B中含有的醛基与C反应转化为羧基,所以试剂C可以为银氨溶液或新制Cu(OH)2悬浊液。
(4)酯基在NaOH条件下发生水解反应,根据水解反应,的原理可写成化学方程式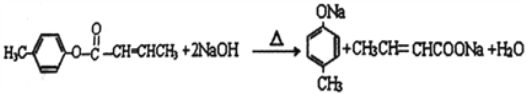 。
。
(5)遇FeCl3 溶液显紫色,说明同分异构体含有酚羟基,则另一个取代基为乙基,二者可为邻、间、对3种位置,共有3种同分异构体;E中含有碳碳双键,经过加聚反应可得E,根据加聚反应规律可得F的结构简式 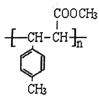 。
。

 精英口算卡系列答案
精英口算卡系列答案【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为______________;
②该反应的热化学方程式为________________________________;
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=____________kJ·mol-1;
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
(3)倒入NaOH溶液的正确操作是_______________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.一次迅速倒入 C.分三次少量倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是_________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:___________。(任意写出一点)