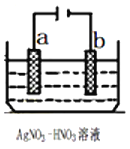
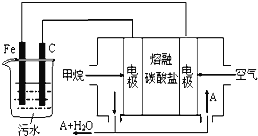
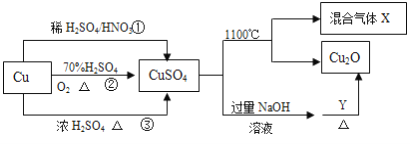
题目内容
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是

A. 200℃时,反应从开始到平衡的平均速率v(A)=0.08molL-1min-1
B. 200℃时,若在第6 min再向体系中充入1 mol He,此时v(正)>v(逆)
C. 若0~5 min内容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)![]() C(g) ΔH= +5m kJ/mol
C(g) ΔH= +5m kJ/mol
D. 200℃时,平衡后再充入2 mol C,则再次达到平衡时,C的体积分数等于0.25
【答案】C
【解析】A.200℃时,反应从开始到平衡的平均速率v(A) = {(0.8-0.4) mol÷2 L}÷5 min = 0.04 mol/(L·min),A错误; 200℃时,若在第6 min再向体系中充入1 mol He,容器体积不变,反应物浓度不变,平衡不移动,此时v(正)=v(逆),故B错误;根据图II,平衡常数K随温度升高而增大,说明正反应吸热;根据图1,若0~5 内min生成C 0.2mol,吸收m kJ能量,则该反应的热化学方程式可表示为:2A(g)+B(g)![]() C(g) ΔH= +5m kJ/mol,故C正确;
C(g) ΔH= +5m kJ/mol,故C正确;
200℃时,平衡后再充入2 mol C,相当于加压,则再次达到平衡时,C的体积分数大于0.25,故D错误。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻。已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸。
(1)D元素基态原子的外围电子排布式为____________________。
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为________________(用相应的元素符号作答)。
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答)。
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
微粒 | CO32- | CO42- |
立体构型名称 | _______________ | _______________ |
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是_______。
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式___________________。
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为___________,δ、γ、α三种晶胞的边长之比为_____________。