题目内容
已知制取氯气也可用浓盐酸与高锰酸钾为原料,其化学方程式为
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。请回答下列问题:
(1)用双线桥法标出该化学式电子转移的方向与数目:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(2)反应中被还原的元素为 (写名称);标准状况下当生成112 L氯气时,反应中转移的电子数目为 。
(3)若有4 molHCl被氧化,则可生成标准状况下的氯气 L。
(4)若有1.58g高锰酸钾和100mL10moL/L浓盐酸充分反应(不考虑盐酸挥发,忽略溶液体积的前后变化),反应至终点时高锰酸钾紫色完全褪去,则被氧化的HCl的物质的量
为 mol。将反应后的溶液取出10mL,加入足量的硝酸银溶液,可得到沉淀的物质的量为 mol。
(1)略(2分) (2)锰 (2分) 10NA(2分) (3)44.8L (2分)
(4)0.05mol(2分)0.95(2分)
解析试题分析:(2)氧化还原反应中,氧化剂,得到电子,化合价降低,被还原,发生还原反应,对应的是还原产物,因此可以分析出被还原的是锰元素。当有5mol的氯气生成时,转移的电子总数为10mol,换成微粒数就是: 10NA。
(3)从方程式上可以看出,反应16mol的盐酸,其中被氧化的只有10mol,转移十摩尔的电子,生成5mol的氯气,因此,若有4 molHCl被氧化,则可生成标准状况下的氯气为2mol ,体保为44.8L 。
(4)1.58g高锰酸钾为0.01mol ,反应中可以看出,每反应2mol的KMnO4,则有10mol的盐酸被氧化,因此,当有0.01mol 的高锰酸钾反应时,被氧化的盐酸的物质的量就为:0.05mol。
2KMnO4+10HCl(浓)+6HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
0.01mol 0.05mol
那么溶液中剩余的氯离子的物质的量为:100mL×10moL/L-0.05mol=0.95mol
将反应后的溶液取出10mL,其中的氯离子的物质的量为0.095mol。加入足量的硝酸银溶液,可得到沉淀的物质的量为0.095mol。
考点:氧化还原的有关知识。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4 - 氧化Fe2+的离子方程式补充完整:
(3)已知:生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
②Ⅳ 中加入MnSO4的目的是 。
实验室里迅速制备少量氯气可利用以下反应:
KMnO4+ HCl  KCl + MnCl2 + Cl2↑ + H2O
KCl + MnCl2 + Cl2↑ + H2O
(1)请配平上述化学方程式,并在上面用“双线桥法” 标明电子转移的方向和数目:
(2)该反应的氧化产物是 ,KMnO4发生 反应。
(3)HCl在上述反应中显示出来的性质是 。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
氧化还原反应在生产、生活中具有广泛用途,贯穿古今。
(1)下列生产、生活中的事例中有发生氧化还原反应的是 。(有两个正确选项)
| A.古代活字印刷 | B.原电池工作 | C.简单机械织布 | D.我国古代湿法炼铜 |
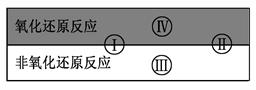
试写出有水参加的符合反应类型Ⅳ的一个化学方程式: 其中水为 剂。
(3)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为: CuO+ NH4Cl = Cu+ CuCl2+ N2+ H2O
①配平此氧化还原反应方程式
②该反应中,被氧化的元素是 (填元素名称),氧化剂是 (填化学式)
③反应中若产生0.2mol的气体,则有 个电子转移。
碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。
完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:
____KI+____CuSO4 → ____I2+____Cu2I2↓+ ____________
该反应中氧化剂与还原剂的物质的量之比为___________。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。
写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是____________________。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:
2Cu2I2+Hg → Cu2HgI4(玫瑰红)+ 2Cu
产物Cu2HgI4中,Cu元素显____价。
当有1 molCu2I2参与反应时,转移电子____mol。
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作。试剂M和操作N的组合正确的是_____(选填编号)
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
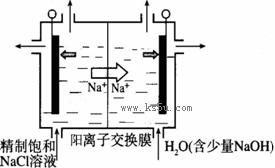
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因 。
ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
 Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。
Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。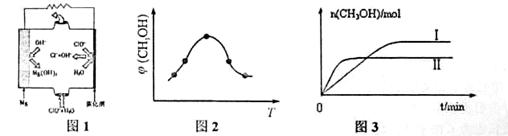
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH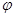 (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。