题目内容
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)除去KNO3溶液中的I2杂质,主要操作步骤是:加CCl4后,振荡,静置, 。水溶液最终从分液漏斗的 分离出来
(3)黑火药是中国的“四大发明”之一。黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S=K2S+2NO2↑+CO2↑。其中被氧化的元素是 ,氧化剂是 ,生成1molCO2时转移的电子数目为(NA表示阿伏伽德罗常数的值)
(1)丁达尔效应 (2)分液,上口 (3)C; KNO3和S; 4NA
解析试题分析:(1)溶液和胶体的鉴别:丁达尔效应;(2)除去KNO3溶液中的I2杂质,萃取和分液,分液时注意,下层液体从下口放出,上层液体从上口倒出;(3)应用氧化还原反应基本概念进行判断,注意标清变价元素的化合价。
考点:考查化学实验---物质的分离提纯及氧化还原反应基本概念。

 高中必刷题系列答案
高中必刷题系列答案二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
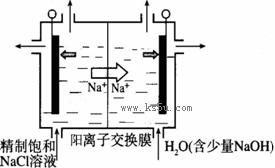
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因 。
ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
②将0.08 mol KMnO4固体(质量为12.64 g)加热一段时间后,收集到a mol O2;向反应后残留的固体中加入足量的浓盐酸,又收集到b mol Cl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:Cl2+2e- =2Cl- 。
回答问题:
(1)试写出①有关的离子方程式:________________________________________________。
(2)请配平②的化学方程式:
____KMnO4+____HCl -______KCl+ _____MnCl2+_____Cl2↑+____ H2O
通过对第②段文字中提供的数据进行计算可得出:a +b的最大值为 ____ ,a +b最小值为_____。
(3)下列四种物质中能使③中的还原过程发生的物质是________。
| A.Na2CO3 | B.KMnO4 | C.XeO3 | D.Na2SO3 |

硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。请填写以下空白:
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①:________________________。 猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
| | 实验操作 | 实验现象 或预期实验现象 | 现象解释 (用离子方程式表示) |
| 猜想② | | 溶液pH约8—10 | |
| 向pH=2的硫酸中滴加Na2S2O3溶液 | | S2O32—+2H+=S↓+SO2↑+H2O | |
| 猜想③ | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________________________________。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是 。
 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。 Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。
Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。 ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。 □Na2ZrO3+□CO2+□H2O
□Na2ZrO3+□CO2+□H2O