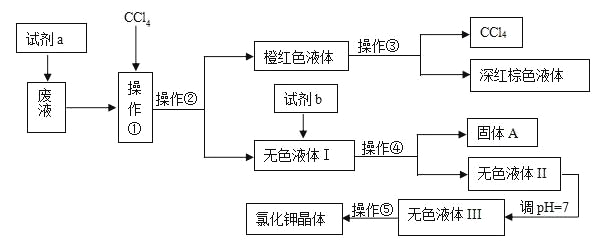
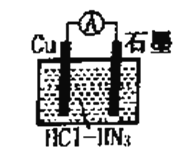
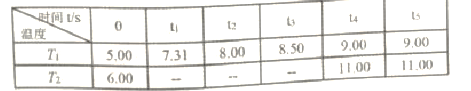
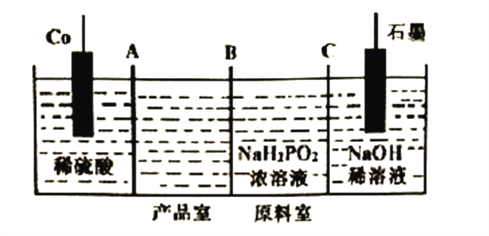
��Ŀ����
����Ŀ��(1)����32 gij���壬Ħ������Ϊ16 g��mol-1����
�ٸ�����Ϊ___________ mol��
�ڸ���������������Ϊ___________ NA��
�۸������ڱ�״���µ����Ϊ_________ L��
(2) _________g H2O�е���ԭ����Ŀ���״����4.48 L CO2�е���ԭ����Ŀ��ͬ��
(3)ͬ��ͬѹ�£�ͬ����İ���(NH3)����������������______����ͬ�����İ������������������_________��
(4)ijԪ��1��ԭ�ӵ�����Ϊa g��1 �� 12Cԭ������Ϊb g�����Ԫ�ص�����ԭ�ӵ����ԭ��������ֵ��_________��_______��
���𰸡�2244.87.217��3232��1712a/b a��NA
��������
(1)����n=m/M=V/Vm=N/N A ���㡣
(2)����n=V/Vm,���������̼�����ʵ��������Oԭ����Ŀ��ȼ���ˮ�����ʵ������ٸ���m=nM����ˮ����������
(3)ͬ��ͬѹ�£�ͬ��������壬����֮�ȵ���Ħ������֮�ȣ�ͬ��ͬѹ�£�ͬ��������������֮����Ħ�������ɷ��ȣ�
��4����һ��12Cԭ��������1/12Ϊ��������ԭ�ӵ�����������Ƚ����õ��ıȣ�Ϊ����ԭ�ӵ����ԭ��������Ħ����������g��mol��1����λ����ֵ�ϵ��ڸ����ʵ���Է������������ԭ��������
(1)����32 gij���壬Ħ������Ϊ16 g��mol-1����
�ٸ�����Ϊn=m/M=32g/16g��mol��1=2mol����
�ڸ���������������Ϊn��NA=2mol��NA=2NA��
�۸������ڱ�״���µ����Ϊn��22.4L��mol��1=2mol��22.4L��mol��1=44.8 L��
(2)��״����4.48 LCO2�����ʵ���Ϊ4.48 L/22.4L��mol��1=0.2mol����֮������ԭ����Ŀ��ͬ��ˮ������Ϊ0.2mol��18g��mol��1��2/1=7.2g��
(3)ͬ��ͬѹ�£�ͬ��������壬����֮�ȵ���Ħ������֮�ȣ���ͬ��ͬѹ�£�ͬ����İ�����NH3����������������Ϊ17g��mol��1��32g��mol��1=17��32��
ͬ��ͬѹ�£�ͬ��������������֮����Ħ�������ɷ��ȣ���ͬ��ͬѹ�£���ͬ�����İ����������������Ϊ32g��mol��1��17g��mol��1=32��17��
(4)һ��12C��������bg��ijԪ��1��ԭ�ӵ�������ag�����ԭ�ӵ����ԭ������=![]() ��
��
1molijԪ��ԭ�ӵ�����ΪaNAg��ԭ�ӵ�Ħ�������������ԭ��������ֵ��ȣ�R�����ԭ������ΪaNA��