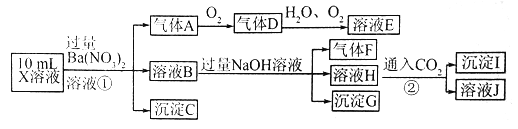
题目内容
【题目】钴是人体必需的微量元素,含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用,请回答下列问题:
(1)Co基态原子的电子排布式为_____________;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到了广泛的应用,其结构如图所示,中心离子为钴离子。

①酞菁钴中三种非金属原子的电负性有大到小的顺序为_____________,(用相应的元素符号作答);碳原子的杂化轨道类型为_____________;
②与钴离子通过配位键结合的氮原子的编号是_____________;
(3)CoCl2中结晶水数目不同呈现不同的颜色。
CoCl2·6H2O(粉红)![]() CoCl2·2H2O(紫红)
CoCl2·2H2O(紫红)![]() CoCl2·H2O(蓝紫)
CoCl2·H2O(蓝紫)![]() CoCl2(蓝色)
CoCl2(蓝色)
CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用:_____________;
(4)用KCN处理含 Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式:_____________;
(5)Co的一种氧化物的晶胞如图所示( ),在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述 CoO2的化学组成的是_____________。
),在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述 CoO2的化学组成的是_____________。

【答案】(1)1s22s22p63s23p63d 74s2或[Ar] 3d74s2;
(2)①N>C>H; sp2;②2、4;
(3)随着硅胶的吸湿和再次烘干,二氯化钴在结晶水合物和无水盐间转化,通过颜色的变化可以表征硅胶的吸湿程度;
(4)2[Co(CN)6]4- +2H2O2![]() [Co(CN)6]3-+H2↑+2OH–;
[Co(CN)6]3-+H2↑+2OH–;
(5)12; D;
【解析】试题分析:(1)Co 是27号元素,其基态原子的电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2。
(2)①酞菁钴中三种非金属原子为C、N、H,三种元素的非金属性的强弱顺序为N>C>H,故其电负性有大到小的顺序为N>C>H;酞菁钴中碳原子都是结构,采取sp2杂化。②形成配位键的 N 原子需含有孤对电子,所以与钴离子通过配位键结合的 N 原子的编号是2、4。
(3)CoCl2中结晶水数目不同呈现不同的颜色。在硅胶中添加 CoCl2,可以随着硅胶的吸湿和再次烘干,二氯化钴在结晶水合物和无水盐间转化,通过颜色的变化可以表征硅胶的吸湿程度。
(4)紫色的[Co(CN)6]4-离子具有强还原性,加热时,紫色的[Co(CN)6]4-离子能水反应生成淡黄色[Co(CN)6]3-,Co元素的化合价升高,将水中的氢元素还原成H2,反应的离子方程式为2[Co(CN)6]4-+2H2O![]() 2[Co(CN)6]3- +H2↑+2OH–。
2[Co(CN)6]3- +H2↑+2OH–。
(5)在 晶体中与一个钴原子等距离且最近的钴原子有12个;CoO2中钴原子和氧原子的个数比为 1︰2。A、钴原子数为 1,氧原子数为 4×1/2=2,数目比为 1︰2,正确;B、钴原子数为 1+4×1/2=2,氧原子数为4,数目比为1︰2,正确;C、钴原子数为4×1/4=1,氧原子数为4×1/2=2,数目比为1︰2,正确;D、钴原子数为1,氧原子数为4×1/4=1,数目比为1︰1,错误。选项D 符合题意。
晶体中与一个钴原子等距离且最近的钴原子有12个;CoO2中钴原子和氧原子的个数比为 1︰2。A、钴原子数为 1,氧原子数为 4×1/2=2,数目比为 1︰2,正确;B、钴原子数为 1+4×1/2=2,氧原子数为4,数目比为1︰2,正确;C、钴原子数为4×1/4=1,氧原子数为4×1/2=2,数目比为1︰2,正确;D、钴原子数为1,氧原子数为4×1/4=1,数目比为1︰1,错误。选项D 符合题意。

【题目】下图是某化学兴趣小组设计的利用电子垃圾(含70% Cu、25% Al、4% Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:

已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
开始沉淀 | 1.1 | 4.0 | 5.4 |
完全沉淀 | 3.2 | 5.2 | 6.7 |
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式:_________________________________。
(2)在操作Ⅱ中,x的取值范围是____________。
(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有________________。
(4)由滤渣a制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣a―→H2SO4―→操作Ⅲ―→Al2(SO4)3·18H2O
乙:滤渣a―→H2SO4―→适量Al粉,过滤―→操作Ⅲ―→Al2(SO4)3·18H2O
丙:滤渣a―→NaOH溶液,过滤―→H2SO4―→操作Ⅲ―→Al2(SO4)3·18H2O
综合考虑上述三种方案,最具可行性的是______(填序号)。
(5)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用b mol·L-1 EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-===CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00 mL(常温时,5%的Na2H2Y水溶液,其pH为4~6),则CuSO4·5H2O晶体的纯度是________________。