题目内容
【题目】某兴趣小组的同学为了制备氯气并探究其性质,回答下列问题。
Ⅰ.写出实验室制取氯气的离子方程式:_______________________________
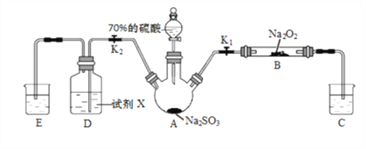
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:
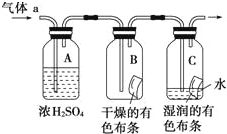
(1)浓硫酸的作用是___________________。
(2)证明氯气和水反应的实验现象为__________。
(3)ICl的性质与Cl2类似,写出ICl与水反应的化学方程式是______________________。
(4)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是______________________。漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是_________________。
【答案】MnO2+4H++2Cl—=Mn2++Cl2 ↑+2H2O 干燥氯气 干燥的有色布条不褪色,湿润的有色布条褪色 ICl+H2O == HCl+HIO 2Cl2+2Ca(OH)2 ==CaCl2+Ca(ClO)2 +2H2O Ca(ClO)2 +CO2+ H2O==CaCO3 ↓+2HClO
【解析】
Ⅰ.二氧化锰与浓盐酸反应生成氯化锰、氯气和水;
Ⅱ.(1)浓硫酸具有吸水性,常用作干燥剂;
(2)干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸;
(3)ICl的性质与Cl2类似,其中碘的非金属性弱于氯,碘显+1价,氯显-1价,ICl与水反应生成HIO和HCl;
(4)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
漂白粉溶于水后,遇到空气中的CO2,反应产生次氯酸。
Ⅰ.二氧化锰与浓盐酸反应生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl—=Mn2++Cl2 ↑+2H2O;
Ⅱ.(1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体a中的水蒸气;
(2)干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,故答案为:干燥的有色布条不褪色,湿润的有色布条褪色;
(3)ICl的性质与Cl2类似,其中碘的非金属性弱于氯,碘显+1价,氯显-1价,ICl与水反应生成HIO和HCl,反应的化学方程式是ICl+H2O == HCl+HIO;
(4)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应方程式为2Cl2+2Ca(OH)2 ==CaCl2+Ca(ClO)2 +2H2O;
漂白粉溶于水后,遇到空气中的CO2,反应产生次氯酸,即产生漂白、杀菌作用,反应的化学方程式是Ca(ClO)2 +CO2+ H2O==CaCO3 ↓+2HClO。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体。
(1)甲同学提出:运用类比学习的思想,Ca与Mg位于同一主族,化学性质具有一定的相似性。请写出Ca在空气中燃烧发生反应的化学方程式_______________________________。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式______________________________。丙同学提出用实验的方法探究放出臭味气体的成分:
(查阅资料)
1.CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3。
2.碘量法是最常用的臭氧测定方法,其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2),臭氧转化为氧气。反应式为O3+2KI+H2O===O2+I2+2KOH。
(提出假设)
假设1:该臭味气体只有NH3;
假设2:该臭味气体只有________;
假设3:该臭味气体含有________。
(设计方案 进行实验探究)
(3)该小组同学设计如下实验方案,并进行实验,验证上述假设。请完成相关的实验操作步骤、预期现象及结论(仪器自选)。
限选实验试剂:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉-KI溶液、蒸馏水。
实验操作 | 预期现象与结论 |
取少量反应后固体于试管中,_____________ | ______________________________________ |