题目内容
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
(4)部分共价键键能数据如下表:
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式: 。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3?10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| | 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
(1)镁;(2)Mn;(3)E;(4)N2(g)+3H2(g)=2NH3(g) △H=-93kJ/mol;
(5)乙醇分子间能形成氢键,而二甲醚不能。(6)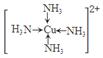
(5)乙醇分子间能形成氢键,而二甲醚不能。(6)

试题分析:(1)钠、镁、铝是同一周期的元素,随着原子序数的增大,原子半径逐渐减小,元素失去电子逐渐减弱,乙醇元素的第一电离能逐渐增大,但是Mg原子的2s轨道上的电子处于全充满的稳定状态,失去电子比后面相邻的Al还难。故这三种元素中第一电离能最大的是Mg;(2)失去2个电子后的某正二价阳离子核外电子排布式为[Ar]3d54s0,有23个电子,则原子有25个电子,所以是25号元素Mn。(3)A. NH4Cl晶体是离子晶体,含有离子键、极性共价键、配位键。错误。B. Na3AlF6晶体是离子晶体,含有离子键、共价键配位键。错误。C. Na2CO3?10H2O晶体是离子晶体,含有离子键、极性共价键、配位键。错误。D. CuSO4溶液中含有离子键、共价键、配位键。错误。E. CH3COOH溶液中含有CH3COOH分子内的极性共价键、非极性性共价键;分子之间的范德华力、氢键、H+与H2O之间的配位键。正确。(4)反应热就是断裂化学键吸收的能量与形成化学键释放的能量的差值。根据各种物质的键能可计算出氮气和氢气合成氨气的热化学方程式:N2(g)+3H2(g)=2NH3(g) △H=-93kJ/mol;(5)乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能。(6)Cu被H2O2氧化为Cu2+,在浓氨水中形成[Cu(NH3)4] 2+而使溶液深蓝色,呈深蓝色的离子的结构简式
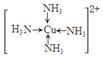 。
。
练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目