题目内容
20.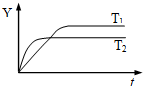 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )| A. | 混合气中氨的体积分数 | B. | 混合气体的密度 | ||
| C. | N2的转化率 | D. | 混合气体的平均摩尔质量 |
分析 根据“先拐先平数值大”知,温度T2到达平衡所用时间短,反应速率较快,故温度T2>T1,该反应的正反应是放热反应,温度升高,平衡逆向移动,Y的物理量降低,Y可以表示反应物的转化率、生成物含量等物理量,结合选项分析解答.
解答 解:根据“先拐先平数值大”知,温度T2到达平衡所用时间短,反应速率较快,故温度T2>T1,该反应的正反应是放热反应,温度升高,平衡逆向移动,Y的物理量降低,
A.升高温度,平衡逆向移动,生成氨气的物质的量减小,则混合气体中氨气的体积分数降低,符合图象,故A不选;
B.反应前后气体总质量不变、容器体积不变,则密度始终不变,与图象不符,故B选;
C.升高温度,平衡逆向移动,则氮气的转化率降低,符合图象,故C不选;
D.升高温度,平衡逆向移动,平衡时混合气体物质的量增大,其平均摩尔质量减小,符合图象,故D不选;
故选B.
点评 本题以图象分析为载体考查外界条件对化学平衡移动的影响,正确判断温度高低是解本题关键,再结合平衡移动分析解答,易错选项是B.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.某学生配制一定物质的量浓度的氢氧化钠溶液,其中不会使溶液浓度偏低的是( )
| A. | 没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 | |
| B. | 容量瓶刚用蒸馏水洗净,没有烘干 | |
| C. | 定容时,加蒸馏水先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 | |
| D. | 定容时仰视刻度线 |
8.从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子O4,但一直没有得到证实,直到意大利一所大学的科学家使用普通氧分子和带正电的氧离子,制造出了新型氧分子.若该氧分子具有空间对称结构,你认为该分子是( )
| A. | 氧元素的一种同位素 | B. | 氧元素的一种同素异形体 | ||
| C. | 一种新的氧化物 | D. | 由离子键构成的 |
15.湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体中可能是①Cl2,②NO2,③CO2,④SO2,⑤HCl,⑥溴蒸气中的( )
| A. | ①③④ | B. | ①②⑤ | C. | ②④⑤ | D. | ①②⑥ |
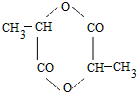
5.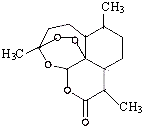 2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )
2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )
 2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )
2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )| A. | 青蒿素与维生素C一样易溶于水 | |
| B. | 青蒿素的晶体为分子晶体,其化学式为C16H20O5 | |
| C. | 青蒿素不能与NaOH溶液反应 | |
| D. | 青蒿素分子有7个手性碳原子 |
12.下列反应均为吸热反应,其中一定不能自发进行的是( )
| A. | NaHSO3(s)═Na2SO3(s)+H2O (g)+SO2(g) | B. | N2O3 (l)═NO2(g)+NO(g) | ||
| C. | MgCO3(s)═MgO(s)+CO2(g) | D. | 2CO(g)═2C(s)+O2(g) |
9.将0.02mol铜片溶于100mL 9mol/L HNO3中,产生336mL气体(只含NO、NO2).该气体与一定量O2混合后,用足量NaOH(aq)完全吸收,产物是NaNO3,则O2的体积至少为(气体体积均为标准状况)( )
| A. | 672 mL | B. | 560 mL | C. | 224 mL | D. | 112 mL |
10. 如图是一种锂离子电池充、放电的工作示意图.放电时该电池的正、负极反应式分别为负极:Li-e-═Li+;正极:Li4Ti5O12+3Li++3e-═Li7Ti5O12.下列说法正确的是( )
如图是一种锂离子电池充、放电的工作示意图.放电时该电池的正、负极反应式分别为负极:Li-e-═Li+;正极:Li4Ti5O12+3Li++3e-═Li7Ti5O12.下列说法正确的是( )
 如图是一种锂离子电池充、放电的工作示意图.放电时该电池的正、负极反应式分别为负极:Li-e-═Li+;正极:Li4Ti5O12+3Li++3e-═Li7Ti5O12.下列说法正确的是( )
如图是一种锂离子电池充、放电的工作示意图.放电时该电池的正、负极反应式分别为负极:Li-e-═Li+;正极:Li4Ti5O12+3Li++3e-═Li7Ti5O12.下列说法正确的是( )| A. | K与N相接时,Li+由A极区迁移到B极区 | |
| B. | 在整个充、放电过程至少存在3种形式的能量转化 | |
| C. | K与M相接时,A是阳极,发生氧化反应 | |
| D. | 放电时当转移1mol电子时应该有0.5mol Li+从右槽迁移进左槽 |
 ,D
,D ;
; ;
; ;
;