题目内容
9.将0.02mol铜片溶于100mL 9mol/L HNO3中,产生336mL气体(只含NO、NO2).该气体与一定量O2混合后,用足量NaOH(aq)完全吸收,产物是NaNO3,则O2的体积至少为(气体体积均为标准状况)( )| A. | 672 mL | B. | 560 mL | C. | 224 mL | D. | 112 mL |
分析 依据铜和硝酸反应失去的电子和生成的氮的氧化物被氧气氧化后和氢氧化钠溶液反应生成盐分析计算判断,利用极值假设分析判断产物,计算需要的氧气体积.
解答 解:刚开始是铜失去电子,将HNO3还原为NO、NO2,后来又是NO、NO2被O2氧化最终变为NaNO3.
若氮的氧化物全部变为NaNO3时需要的O2最多;
HNO3→NaNO3:铜失去的电子正好给了氧气,则氧气物质的量为0.01mol,体积为0.01mol×22.4L/mol=0.224L=224L;
故选:C.
点评 本题考查了硝酸性质应用和化学方程式计算,主要是氧化还原反应电子守恒的计算应用和极值计算方法,题目难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
18.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 常温下,78gNa2O2与足量的水反应转移电子数为2NA | |
| B. | 常温常压下,8g O3所含电子数为4NA | |
| C. | 0.1mol/L的Na2CO3溶液中所含Na+数目为0.2NA | |
| D. | 标准状况下,22.4L CCl4含CCl4分子数为NA |
20.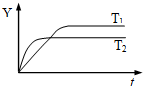 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )
 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )| A. | 混合气中氨的体积分数 | B. | 混合气体的密度 | ||
| C. | N2的转化率 | D. | 混合气体的平均摩尔质量 |
17.某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是( )
①分子中具有12个氢原子的烷烃 ②分子中具有4个碳原子的烷烃
③分子中具有7个碳原子的芳香烃 ④分子中具有8个碳原子的烷烃.
①分子中具有12个氢原子的烷烃 ②分子中具有4个碳原子的烷烃
③分子中具有7个碳原子的芳香烃 ④分子中具有8个碳原子的烷烃.
| A. | ①② | B. | ①④ | C. | ③④ | D. | ②④ |
4.化学与科学、技术、社会、环境密切相关.下列叙述正确的是( )
| A. | 普通玻璃的主要成分是纯碱、石灰石和二氧化硅 | |
| B. | “光化学烟雾”与碳氢化合物和氮氧化合物的大量排放有关 | |
| C. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| D. | C、S分别在空气中燃烧均可得到两种不同的氧化物 |
14. 钠硫电池是一种新型二次电源,电池总反应为2Na+xS$\frac{\underline{\;放电\;}}{充电}$Na2Sx.该电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷可传导Na+,电池装置如图所示,下列说法正确的是( )
钠硫电池是一种新型二次电源,电池总反应为2Na+xS$\frac{\underline{\;放电\;}}{充电}$Na2Sx.该电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷可传导Na+,电池装置如图所示,下列说法正确的是( )
 钠硫电池是一种新型二次电源,电池总反应为2Na+xS$\frac{\underline{\;放电\;}}{充电}$Na2Sx.该电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷可传导Na+,电池装置如图所示,下列说法正确的是( )
钠硫电池是一种新型二次电源,电池总反应为2Na+xS$\frac{\underline{\;放电\;}}{充电}$Na2Sx.该电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷可传导Na+,电池装置如图所示,下列说法正确的是( )| A. | 放电时,Na2Sx被还原 | |
| B. | 放电时,电极B为负极 | |
| C. | 充电时,Na+从左向右移动 | |
| D. | 充电时,阳极的电极反应为:Sx2--2e-═x S |
18.下列实验操作能达到目的是( )
| A. | 用金属钠检验酒精中是否含有水 | |
| B. | 为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤,弃去沉淀 | |
| C. | 为除去乙烷中的少量乙炔,将混和气体通过酸性高锰酸钾溶液即可 | |
| D. | 将C2H5Br和NaOH溶液混合后振荡,用稀硝酸酸化后,再加入AgNO3溶液检验来C2H5Br中的溴元素 |

 .
. +Br2→
+Br2→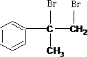 ;E→F
;E→F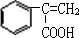 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.