题目内容
15.湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体中可能是①Cl2,②NO2,③CO2,④SO2,⑤HCl,⑥溴蒸气中的( )| A. | ①③④ | B. | ①②⑤ | C. | ②④⑤ | D. | ①②⑥ |
分析 淀粉遇碘变蓝,显然碘化钾中的碘离子被氧化生成单质碘.
解答 解:①中氯气能将碘离子氧化为单质碘,Cl2+2I-=2Cl-+I2;
②中NO2具有强氧化性,能将碘离子氧化为单质碘;
③中CO2不能将碘离子氧化为单质碘;
④中SO2不能将碘离子氧化为单质碘;
⑤HCl不能将碘离子氧化为单质碘;
⑥溴蒸气能将碘离子氧化为单质碘,Br2+2I-=2Br-+I2;
故选D.
点评 本题考查单质碘的检验以及氧化还原反应的规律,注意氧化性强弱顺序是:氯气>溴>碘.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 乙烯和聚乙烯都可以发生加成反应 | |
| B. | 甲苯分子中的所有碳原子共平面,聚乙烯分子中的所有碳原子共直线 | |
| C. | 乙酸乙酯、油脂分别在NaOH溶液中反应都有醇生成 | |
| D. | Ba2+中毒,可以吃煮熟的鸡蛋解毒 |
3.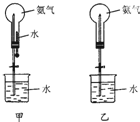 制取氨气并完成喷泉实验(图中夹持装置均以略去)
制取氨气并完成喷泉实验(图中夹持装置均以略去)
(1)写出实验室制取氨气的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)收集氨气使用向下排空气方法,要得到干燥的氨气可选用碱石灰做干燥剂.
(3)用甲装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是打开止水夹,挤出胶头滴管中的水.该实验的原理是氨气极易溶解于水,致使烧瓶内气体压强迅速减小.
(4)如果只提供乙图装置,请设计引发喷泉的方法打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉.
(5)现将甲中的NH3和水换成下列气体和液体,不能全部充入上述装置中的选项是,并说明理由(可不填满):
①选项是A,理由是二氧化氮与水反应有会有一氧化氮气体生成,能形成喷泉,但不能充满;
②选项是C,理由是氯气不溶于饱和氯化钠溶液;
③选项是.,理由是.;
④选项是.,理由是..
 制取氨气并完成喷泉实验(图中夹持装置均以略去)
制取氨气并完成喷泉实验(图中夹持装置均以略去)(1)写出实验室制取氨气的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)收集氨气使用向下排空气方法,要得到干燥的氨气可选用碱石灰做干燥剂.
(3)用甲装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是打开止水夹,挤出胶头滴管中的水.该实验的原理是氨气极易溶解于水,致使烧瓶内气体压强迅速减小.
(4)如果只提供乙图装置,请设计引发喷泉的方法打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉.
(5)现将甲中的NH3和水换成下列气体和液体,不能全部充入上述装置中的选项是,并说明理由(可不填满):
| 气体 | 液体 | |
| A | NO2 | 水 |
| B | CO2 | 4mol•L-1NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol•L-1盐酸 |
②选项是C,理由是氯气不溶于饱和氯化钠溶液;
③选项是.,理由是.;
④选项是.,理由是..
10.如图是元素周期表的一部分,下列说法正确的是( )
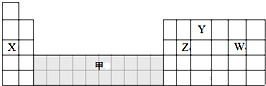

| A. | 可在灰色区域“甲”中寻找催化剂 | |
| B. | 离子半径:W->X+>Y3- | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | 工业上电解X和W化合物的水溶液制备X |
20.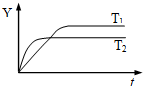 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )
 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应,如图是某物理量Y随时间(t)变化的示意图,Y不可以是( )| A. | 混合气中氨的体积分数 | B. | 混合气体的密度 | ||
| C. | N2的转化率 | D. | 混合气体的平均摩尔质量 |
7.已知甲苯的一氯代物有4种,则甲苯完全氢化后的一氯代物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
4.化学与科学、技术、社会、环境密切相关.下列叙述正确的是( )
| A. | 普通玻璃的主要成分是纯碱、石灰石和二氧化硅 | |
| B. | “光化学烟雾”与碳氢化合物和氮氧化合物的大量排放有关 | |
| C. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| D. | C、S分别在空气中燃烧均可得到两种不同的氧化物 |
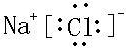 ,C
,C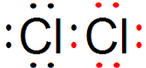 ,D
,D ,F
,F ,E
,E ;
; 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )