题目内容
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见![]() 、
、![]() 和
和![]() 价等价态。工业上以铬铁矿
价等价态。工业上以铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠![]() 已知
已知 ![]() 是一种强氧化剂
是一种强氧化剂![]() ,其主要工艺流程如下:
,其主要工艺流程如下:
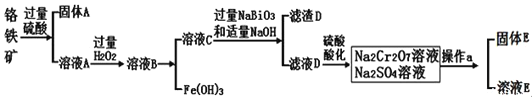

查阅资料得知:常温下,![]() 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将![]() 转化为
转化为![]()
回答下列问题:
![]() 工业上常采用热还原法制备金属铬,写出以
工业上常采用热还原法制备金属铬,写出以![]() 为原料,利用铝热反应制取金属铬的化学方程式_______________。
为原料,利用铝热反应制取金属铬的化学方程式_______________。
![]() 酸化滤液D时,不选用盐酸的原因是_____________。
酸化滤液D时,不选用盐酸的原因是_____________。
![]() 固体E的主要成分是
固体E的主要成分是![]() ,根据如图分析操作a为________________、____________、洗涤、干燥。
,根据如图分析操作a为________________、____________、洗涤、干燥。
![]() 已知含
已知含![]() 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的
价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的![]() 。
。
![]()
![]() 的化学性质与
的化学性质与 ![]() 相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________![]() 用离子方程式表示
用离子方程式表示![]() ;
;
![]() 下列溶液中可以代替上述流程中
下列溶液中可以代替上述流程中![]() 溶液最佳的是___________
溶液最佳的是___________![]() 填选项序号
填选项序号![]() ;
;
A ![]() 溶液
溶液 ![]() 浓
浓![]()
![]() 酸性
酸性![]() 溶液
溶液 ![]() 溶液
溶液
![]() 上述流程中,每消耗
上述流程中,每消耗![]() 转移
转移![]() ,则加入
,则加入![]() 溶液时发生反应的离子方程式为_____________。
溶液时发生反应的离子方程式为_____________。
![]() 某厂废水中含
某厂废水中含![]() 的
的![]() ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 ![]() 的化合价为
的化合价为![]() ,Fe的化合价依次为
,Fe的化合价依次为![]() 、
、![]() 。欲使1L该废水中的
。欲使1L该废水中的 ![]() 完全转化为
完全转化为![]() 。理论上需要加入________
。理论上需要加入________![]() 。
。
![]() 已知
已知![]() 摩尔质量为
摩尔质量为![]()
【答案】
![]() 会氧化
会氧化![]() 生成氯气,造成污染 蒸发结晶 趁热过滤
生成氯气,造成污染 蒸发结晶 趁热过滤 ![]()
![]()
![]()
![]()
【解析】
根据流程:铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 用过量的硫酸酸浸,
用过量的硫酸酸浸,![]() 不溶,过滤,固体A为
不溶,过滤,固体A为![]() ,溶液A为含有
,溶液A为含有![]() 、
、![]() 、
、![]() 的酸性溶液,加入过量过氧化氢氧化
的酸性溶液,加入过量过氧化氢氧化![]() 为
为![]() ,调节pH除去
,调节pH除去![]() ,溶液C含有
,溶液C含有![]() 、
、![]() ,加入过量
,加入过量![]() ,NaOH,在碱性条件下,能将
,NaOH,在碱性条件下,能将![]() 转化为
转化为![]() ,
,![]() 沉淀,滤液D含有
沉淀,滤液D含有![]() ,加入硫酸酸化得到含有的
,加入硫酸酸化得到含有的![]() 和
和![]() 的溶液,蒸发结晶,趁热过滤、洗涤、干燥得到
的溶液,蒸发结晶,趁热过滤、洗涤、干燥得到![]() ,以此解答此题。
,以此解答此题。
根据上述分析可知:
![]() 利用铝热反应制取金属铬的化学方程式:
利用铝热反应制取金属铬的化学方程式: ;
;
故答案为: ;
;
![]() 是一种强氧化剂,
是一种强氧化剂,![]() 会氧化
会氧化![]() 生成氯气,造成污染,故酸化滤液D时,不选用盐酸;
生成氯气,造成污染,故酸化滤液D时,不选用盐酸;
故答案为:![]() 会氧化
会氧化![]() 生成氯气,造成污染;
生成氯气,造成污染;
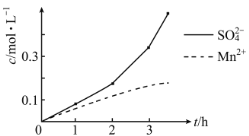
![]() 由图2可知
由图2可知![]() 的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
故答案为:蒸发结晶;趁热过滤;
![]() 的化学性质与
的化学性质与![]() 相似,如果氢氧化钠过量
相似,如果氢氧化钠过量![]() 会溶解,发生离子方程式为:
会溶解,发生离子方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 可以代替上述流程中
可以代替上述流程中![]() 溶液,需要具有还原性,能还原重铬酸根离子;
溶液,需要具有还原性,能还原重铬酸根离子;
A.![]() 溶液中亚铁离子具有还原性,可以还原
溶液中亚铁离子具有还原性,可以还原![]() 离子,但又引入新的杂质离子铁离子,故A不符合;
离子,但又引入新的杂质离子铁离子,故A不符合;
B.浓![]() 具有强氧化性,不能表现还原性,不能还原
具有强氧化性,不能表现还原性,不能还原![]() ,故B不符合;
,故B不符合;
C.酸性![]() 是强氧化剂不能还原
是强氧化剂不能还原![]() ,故C不符合;
,故C不符合;
D.![]() 溶液中亚硫酸根离子具有还原性,可以还原
溶液中亚硫酸根离子具有还原性,可以还原![]() ,故D符合;
,故D符合;
故答案为:D;
![]() 每消耗
每消耗![]() 转移
转移![]() ,
,![]() ,
,![]() ,依据氧化还原反应电子守恒配平书写,
,依据氧化还原反应电子守恒配平书写,![]() ,
,![]() ,得到的氧化还原反应的离子方程式为
,得到的氧化还原反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
![]() 根据
根据![]() 中,Cr:
中,Cr:![]() :
:![]() :5;故有
:5;故有![]() ,故质量为
,故质量为![]() ;
;
故答案为:![]() 。
。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:
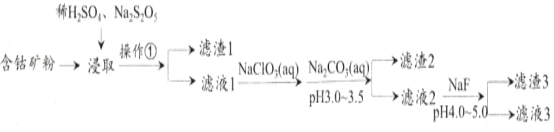
已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mn2+ | Mg2+ | |
开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 8.3 | 9.6 |
完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 9.3 | 11.1 |
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3/span>的作用是_______________________________________,相关的离子方程式为__________________________________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为________________________(写化学式)。
滤液3经过多次萃取与反萃取制备CoCl2晶体
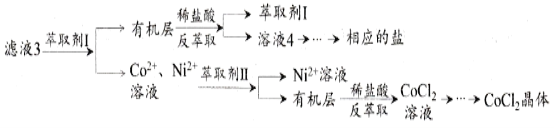
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是_______________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是_________________________________。
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:
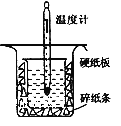
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是___________________________________。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于_________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_________。(提示:ΔH=-![]() ,保留一位小数)。
,保留一位小数)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(6)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”)。
【题目】“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:
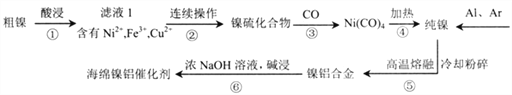
己知:25℃时,以0.1mol/L金属离子测定得到如下数据:
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
Ksp | 6×10-36 | 3×10-19 | ||||
pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
沉淀完全 | 6.7 | 9.2 | 3.2 | |||
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________。
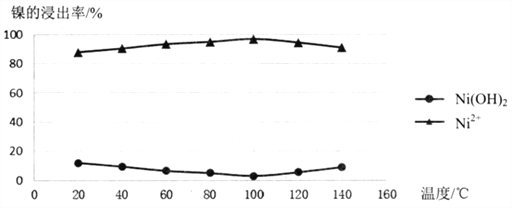
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________。
(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______(填pH的取值范围);再加_______(选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________。