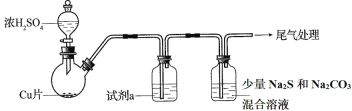
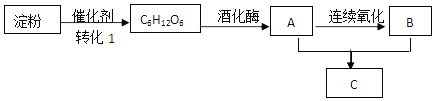
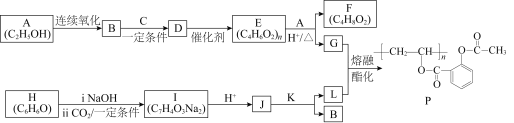
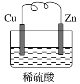
题目内容
【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:
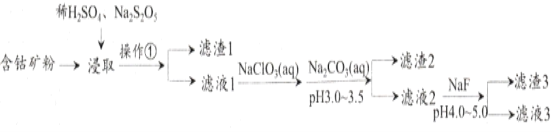
已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mn2+ | Mg2+ | |
开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 8.3 | 9.6 |
完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 9.3 | 11.1 |
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3/span>的作用是_______________________________________,相关的离子方程式为__________________________________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为________________________(写化学式)。
滤液3经过多次萃取与反萃取制备CoCl2晶体
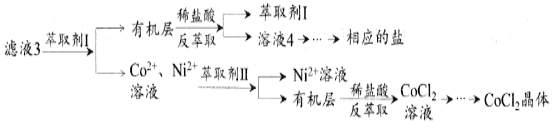
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是_______________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是_________________________________。
【答案】过滤 氯酸钠 将正三价钴还原成正二价钴 将Fe2+氧化成Fe3+,便于分离 6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑ CaF2和MgF2 分离出溶液中的Mn2+、Cu2+、Zn2+,回收利用 降低烘干温度,防止产品分解,产生有毒的无水氯化钴
【解析】
流程题先找出原料和杂质,以及制备的物质,注意题中所给信息的运用,带着问题看流程,流程题一般是杂质的处理和物质的提纯;
(1)根据流程,操作①得到滤渣和滤液,即操作①为过滤;NaClO3具有氧化性,其名称为氯酸钠;
(2)根据信息①,Na2S2O5常作食品抗氧化剂,即Na2S2O5为还原剂,根据含钴矿中Co存在的化合价,以及该流程制备氯化钴,因此Na2S2O5将正三价钴还原成正二价钴;
(3)根据加入NaClO3后的操作,“加入Na2CO3,调节pH3.0~3.5”,其目的是让Fe3+以Fe(OH)3形式沉淀出来,除去铁元素,即加入NaClO3的目的是将Fe2+氧化成Fe3+,便于分离;反应的离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(4)Na2CO3与Fe3+发生双水解反应,其离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
(5)根据题中信息①,CaF2和MgF2难溶于水,因此滤渣3的成分是CaF2和MgF2;
(6)根据流程,把Fe、Si、Ca、Mg等杂质元素除去,而Cu、Zn、Mn、Ni等杂质还没除去,滤液3加入萃取剂I,得到有机层和Co2+、Ni2+,溶液,即有机层中含有Cu、Zn、Mn元素,因此加入稀盐酸反萃取的目的是分离出溶液中的Mn2+、Cu2+、Zn2+,回收利用;
(7)CoCl2·6H2O熔点86℃,易溶于水、乙醚等,常温下稳定无毒,加热至110-120℃时,失去结晶水变成有毒的无水氯化钴,因此减压环境下烘干的原因是降低烘干温度,防止产品分解,产生有毒的无水氯化钴。