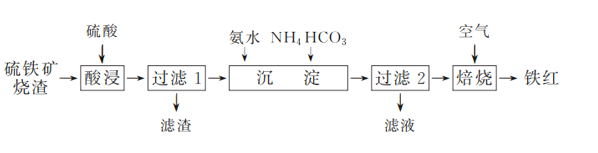
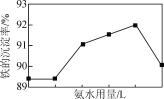
��Ŀ����
����Ŀ������������⡣
��1����Ԫ�����ﱡĤ̫���ܵ�ز���Ϊ���Σ�����Ҫ�����黯�أ�GaAs�������ӣ�CdS����Ĥ��صȣ�
��As�Ļ�̬ԭ�ӵĵ����Ų�ʽ[Ar]_______________.
�ڵ�һ�����ܣ�As___Ga����������������������=������
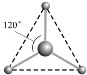
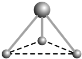
��2�������Fe(CO)5�����³�Һ̬,�۵�Ϊ-20.5 ��,������ CCl4 ��,��Fe(CO)5��______���ӣ��Ǽ��Ի��ԣ���
��3��BF3�����������壬��ǿ�ҵĽ��ܹµ��ӶԵ�����BF3��NH3�������������ɰ�ɫ���塣BF3���ӻ��������Ϊ��____ ��д���ð�ɫ����Ľṹʽ������ע�����е���λ��___________��
��4�������й�˵������ȷ����____��
A���е㣺NH3 >PH3��CH3OH > HCHO
B��SO2��CO2�Ļ�ѧ������Щ���ƣ����ռ�ṹ���ӻ���ʽ��ͬ
C���ۡ��е�: SiF4< SiCl4< SiBr4 <SiI4 , ԭ���Ƿ����й��ۼ�����������
D���۵�: CaO > KCl > KBr��ԭ���Ǿ�������С

��5���ƼغϽ����ڽ������壬ij�ֺϽ�ľ����ṹ��ͼ��ʾ��������K ԭ�ӵ���λ��Ϊ______����֪����ԭ�Ӱ뾶r��Na����r��K�������㾧��Ŀռ������� __________������ԭ���Ǹ������壩
���𰸡�3d104s24p3 > �Ǽ��� sp2 ![]() C 6
C 6 ![]()
��������
��As��33��Ԫ�أ���ԭ�ӽṹʾ��ͼΪ �����̬ԭ�ӵĵ����Ų�ʽΪ[Ar]3d104s24p3��
�����̬ԭ�ӵĵ����Ų�ʽΪ[Ar]3d104s24p3��
��ͬһ�����У�Ԫ�ص�һ�����ܳ��������ƣ���As��p���Ϊ������ṹ���Ե�һ������As��Ga�������Fe(CO)5�۵�Ϊ-20.5�棬�е�Ϊ103�棬������CCl4��CCl4�ǷǼ����ܼ������ݷ��Ӿ�����������ʣ����Ӿ����۷е�ͣ��������л��ܼ����������ڷ��Ӿ��壬�ǷǼ��Է��ӣ�
(3)Bԭ�۵�����Ϊ3���¶Ե��ӣ���BF3���ӻ��������Ϊsp2��Bԭ����ǿ�ҵĽ��ܹµ��ӶԵ�����NH3������Nԭ����һ���µ��Ӷԣ�BF3��NH3�������������ɰ�ɫ����BF3NH3���ð�ɫ����ĽṹʽΪ![]() ��
��
(4)A��NH3��CH3OH���Ӽ�������������Ӧ�ķе�ϸߣ���е�NH3 >PH3��CH3OH > HCHO����A��ȷ��B�����������������̼��Ϊ�����������ѧ�������ƣ�������̼����Ϊsp2�ӻ���ֱ���ͽṹ������������Ϊsp4�ӻ���V�νṹ����B��ȷ��C��SiF4��SiCl4��SiBr4 ��SiI4 �ṹ���ƣ���Է�������Խ���Ӽ�������Խ�����ۡ��е�Խ�ߣ��빲�ۼ����أ���C����D�����Ӿ���ľ�����Խ���ۡ��е�Խ�ߣ���D��ȷ����ΪC��
(5)���ݾ�̯����֪����������ԭ����Ϊ12��![]() =3����ԭ����Ϊ8��
=3����ԭ����Ϊ8��![]() =1�����ԺϽ�Ļ�ѧʽΪKNa3�����ݾ���ͼ��֪��ÿ��Kԭ����Χ��6����ԭ�ӣ����Ծ�����Kԭ�ӵ���λ��Ϊ6����������ԭ�Ӻͼ�ԭ�����֮��Ϊ
=1�����ԺϽ�Ļ�ѧʽΪKNa3�����ݾ���ͼ��֪��ÿ��Kԭ����Χ��6����ԭ�ӣ����Ծ�����Kԭ�ӵ���λ��Ϊ6����������ԭ�Ӻͼ�ԭ�����֮��Ϊ![]() ��(r3(Na)��3+r3(K))�����ݾ����Ľṹ��֪�������ı߳�Ϊ��ԭ�Ӻͼ�ԭ�ӵ�ֱ��֮��Ϊ2��[r(Na)+r(K)]�����Ծ��������Ϊ[2��r(Na)+2��r(K)]3������Ŀռ�������Ϊ
��(r3(Na)��3+r3(K))�����ݾ����Ľṹ��֪�������ı߳�Ϊ��ԭ�Ӻͼ�ԭ�ӵ�ֱ��֮��Ϊ2��[r(Na)+r(K)]�����Ծ��������Ϊ[2��r(Na)+2��r(K)]3������Ŀռ�������Ϊ![]() =
=![]() ��
��

 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д� �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д�