��Ŀ����
����Ŀ��NaOH��Һ�����ڶ�������Ĵ�����
(1)CO2���������壬����NaOH��Һ���յõ�Na2CO3��NaHCO3��
��Na2CO3�׳ƴ����CO32��ˮ���ʹ��ˮ��Һ�ʼ��ԣ�д��CO32����һ��ˮ������ӷ���ʽ_________����֪25��ʱ��CO32����һ��ˮ���ƽ�ⳣ��Kh=2��10��4mol/L������Һ��c��HCO3������c��CO32����=20��1 ʱ����Һ��pH=_____��
����ĭ�������ͨ��װ��NaHCO3 ��Һ��Al2(SO4)3��Һ����д����������Һ���ʱ�����ӷ�Ӧ����ʽ__________��
(2)������Ũ���ᷴӦ������NO2����NaOH��Һ���գ���Ӧ����ʽΪ��2NO2+2NaOH=NaNO3+NaNO2+H2O����0.2molNaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ҺBΪ0��lmolL��1CH3COONa��Һ����������Һ��c��NO3������c��NO2������c��CH3COO�����ɴ�С��˳��Ϊ___________����֪HNO2�ĵ��볣��Ka=7.1��10��4molL��1��CH3COOH�ĵ��볣��Ka=1.7��10��5molL��1������ʹ��ҺA����ҺB�� pH��ȵķ�����_____��
A������ҺA�м�����NaOH B������ҺA�м�����ˮ
C������ҺB�м�����NaOH D������ҺB�м�����ˮ
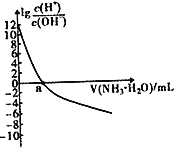
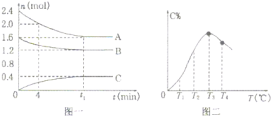
(3)�����е�SO2���������꣬����������������Һ���ա�����SO2�Ĺ����У���Һ��H2SO3��HSO3����SO32��������ռ���ʵ���������a����pH�仯�Ĺ�ϵ��ͼ��ʾ��

��ͼ��pH=7ʱ����Һ������Ũ�ȹ�ϵ��ȷ����___��
A��c��Na+����2c��SO32������c��HSO3����
B��c��Na+��=c��SO32����+c��HSO3����+c��H2SO3��
C��c��OH����=c��H+��+c��H2SO3��+c��HSO3����
D��c��Na+����c��HSO3������c��SO32������c��H+��=c��OH����
��������ͼ�����ݣ���ӦH2SO3![]() H++ HSO3����ƽ�ⳣ������ֵ____��
H++ HSO3����ƽ�ⳣ������ֵ____��
���𰸡�CO32��+H2O ![]() HCO3��+OH�� 9 3HCO3��+Al3+=Al(OH)3��+3CO2�� c��NO3������c��NO2������c��CH3COO���� AD A 10-1.8
HCO3��+OH�� 9 3HCO3��+Al3+=Al(OH)3��+3CO2�� c��NO3������c��NO2������c��CH3COO���� AD A 10-1.8
��������
(1)��CO32-ˮ���ʹ��ˮ��Һ�ʼ��ԣ���CO32-��һ��ˮ������ӷ���ʽΪ��CO32-+H2OHCO3-+OH-��ˮ�ⳣ��Kh=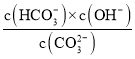 ������Һ��c(HCO3-)��c(CO32-)=20��1ʱ������ˮ�ⳣ������c(OH-)���ɸ���ˮ�����ӻ�Kw����c(H+)������pH=-lgc(H+)���㣻
������Һ��c(HCO3-)��c(CO32-)=20��1ʱ������ˮ�ⳣ������c(OH-)���ɸ���ˮ�����ӻ�Kw����c(H+)������pH=-lgc(H+)���㣻
��Al2(SO4)3��NaHCO3���ʱ����ٽ�ˮ��������������������������̼���壻
(2)��ҺA��NaNO3��NaNO2��Ũ�Ⱦ�Ϊ0.1mol/L��HNO2��CH3COOH��Ϊ���ᣬ�ɵ��볣����֪CH3COOH����С��HNO2�����ԣ���Һ�д��������ˮ��̶ȴ��������������ˮ��̶ȣ���ҺB���Դ���A��Һ��
(3)��A���ɵ���غ��֪��c(H+)+c(Na+)�T2c(SO32-)+c(HSO3-)+c(OH-)��������Һ��c(H+)�Tc(OH-)����c(Na+)�T2c(SO32-)+c(HSO3-)������c(Na+)��2c(SO32-)����ͼ��֪pH=7ʱ��c(SO32-)=c(HSO3-)����c(Na+)��2c(SO32-)��c(HSO3-)����A ��ȷ��
B���ɵ���غ��֪��c(H+)+c(Na+)�T2c(SO32-)+c(HSO3-)+c(OH-)��������Һ��c(H+)�Tc(OH-)����c(Na+)�T2c(SO32-)+c(HSO3-)��c(SO32-)��c(H2SO3)����B����
C��pH=7ʱ��c(H+)=c(OH-)��
D��HSO3-����̶ȴ���ˮ��̶ȵ�����Һ�����ԣ���Ϊ������������Ӽ��ܵ�������ˮ�⣬������Һ�д���H2SO3��SO32-����NaHSO3��Һ�д��ڵ���غ�������غ㣬���ݵ���غ�������غ��жϣ�
��H2SO3![]() H++ HSO3������ͼ�����ݣ�pH=1.8ʱ��c(H2SO3 )=c(HSO3- )����Ka�ı���ʽ��֪��H2SO3�ĵ�һ������ƽ�ⳣ��Ka1��c(H+)=10-1.8���ɴ˷������
H++ HSO3������ͼ�����ݣ�pH=1.8ʱ��c(H2SO3 )=c(HSO3- )����Ka�ı���ʽ��֪��H2SO3�ĵ�һ������ƽ�ⳣ��Ka1��c(H+)=10-1.8���ɴ˷������
(1)��CO32��ˮ���ʹ��ˮ��Һ�ʼ��ԣ�CO32����һ��ˮ������ӷ���ʽΪ��CO32��+H2OHCO3��+OH����ˮ�ⳣ��Kh=2��10��4������Һ��c(HCO3-)��c(CO32��)=20��1ʱ��c(OH��)=10��5mol/L����ˮ�����ӻ�Kw��֪��c(H+)=10��9mol/L������pH=��lg10��9=9��
��Al2(SO4)3��NaHCO3���ʱ����ٽ�ˮ��������������������������̼���壬���ӷ���ʽΪAl3++3HCO3���TAl(OH)3��+3CO2����
(2)0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����2NO2+2NaOH�TNaNO3+NaNO2+H2O���õ���ҺA��NaNO3���ʵ���Ũ��Ϊ0.1mol/L��NaNO2���ʵ���Ũ��Ϊ0.1mol/L����ҺBΪ0.1molL��1��CHCOONa��Һ�� HNO2�ĵ��볣��Ka=7.1��10��4molL��1��CH3COOH�ĵ��볣��Ka=1.7��10��5molL��1��˵��CH3COOH����С��HNO2�����ԣ���Һ�д��������ˮ��̶ȴ��������������ˮ��̶ȣ���ҺB���Դ���A��Һ������Һ��c(NO3��)��c(NO2��)��c(CH3COO��)�ɴ�С��˳��Ϊc(NO3��)��c(NO2��)��c(CH3COO��)��
A������ҺA�м�����NaOH��������ԣ����Ե�����ҺpH��ȣ���A��ȷ��
B����ҺB���Դ���A��Һ������ҺA�м�����ˮ��ϡ����Һ�����Լ��������ܵ�����ҺpH��ȣ���B����
C����ҺB���Դ���A��Һ������ҺB�м�����NaOH����ҺpH����C����
D������ҺB�м�����ˮ��ϡ����Һ���Լ��������Ե�����ҺpH��ȣ���D��ȷ��
�ʴ�ΪAD��
(3)��A���ɵ���غ��֪��c(H+)+c(Na+)�T2c(SO32��)+c(HSO3��)+c(OH��)��������Һ��c(H+)�Tc(OH��)����c(Na+)�T2c(SO32��)+c(HSO3��)������c(Na+)��2c(SO32��)������ͼ��֪pH=7ʱ��c(SO32��)=c(HSO3��)����c(Na+)��2c(SO32��)��c(HSO3��)����A ��ȷ��
B���ɵ���غ��֪��c(H+)+c(Na+)�T2c(SO32��)+c(HSO3��)+c(OH��)��������Һ��c(H+)�Tc(OH��)����c(Na+)�T2c(SO32��)+c(HSO3��)��c(SO32��)��c(H2SO3)����B����
C��pH=7ʱ��c(H+)=c(OH��)����C����
D����ͼ��֪pH=7ʱ��c(SO32��)=c(HSO3��)����D����
�ʴ�ΪA��
��������ĵ�һ�����뷽��ʽΪ��H2SO3![]() H++HSO3��������ͼ���֪��pH=1.8ʱ��c(H2SO3 )=c(HSO3- )����Ka=
H++HSO3��������ͼ���֪��pH=1.8ʱ��c(H2SO3 )=c(HSO3- )����Ka= ��֪��H2SO3�ĵ�һ������ƽ�ⳣ��Ka1��c(H+)=10-1.8��
��֪��H2SO3�ĵ�һ������ƽ�ⳣ��Ka1��c(H+)=10-1.8��

 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�����Ŀ������ʵ�鷽�������ﵽ��ӦĿ�ĵ���
A | B | C | D | |
Ŀ�� | �Ƚ�̼�����̼�����ˮ��̶� | �о�Ũ�ȶԻ�ѧƽ���Ӱ�� | �Ƚϲ�ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�� | �Ƚ�̼�ᡢ��������������ǿ�� |
ʵ�鷽�� |
|
|
|
|
A. AB. BC. CD. D