��Ŀ����
����Ŀ���������� 0.1mol/LNaOH ��Һ 500mL����ͼ��ijͬѧת����Һ��ʾ��ͼ��
(1)ͼ�еĴ�����__________________������ͼ�и����ĵ�������������ƽ�⣬����Ҫ�������У�_____________.
(2)���ݼ����֪������NaOH������Ϊ_______________.
(3)����ʱ������ȷ�IJ���˳���ǣ���ĸ��ʾ��ÿ����ĸֻ����һ�Σ�____________________________.

A���� 30mL ˮϴ���ձ� 2~3 �Σ�ϴ��Һ��ע������ƿ
B��ȷ��ȡ���������������ƹ������ձ��У��ټ�������ˮ��Լ 30mL�����ò���������������ʹ�����ܽ�
C�����ܽ������������Һ�ز�����ע�� 500mL ������ƿ��
D��������ƿ�ǽ��������ߵ�ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶� 1~2cm ��
(4)�����������������������ҺŨ�Ƚ��к�Ӱ�죨����ƫ��������ƫ����������Ӱ������?
��û��ϴ���ձ� _________________ ��������ˮʱ���������˿̶���________________________ ������ʱ���ӿ̶��� ________________________ .
���𰸡�δ�ò��������� ��ͷ�ι��������� 2.0g BCAFED ƫ�� ƫ�� ƫ��
��������
(1)������ƿ��ת��Һ��ʱӦ�ò������������ʸ�ͼ�Ĵ�����δ�ò�����������(2). ������Һʱ��Ҫ����ƿ���ձ��ͽ�ͷ�ιܡ��������������� (2)������Һ��Ҫ���������ƹ��������Ϊ0.1mol/L��0.5L��40g/mol=2.0g��(3)������Һ��һ��IJ���Ϊ���㣬�������ܽ⣬ת�ƣ�ϴ�ӣ����ݣ�ҡ�ȵȣ�����ʱҪע��Һ����̶���1~2cm ��ʱ���ý�ͷ�ιܼ�ˮʹ��Һ����ǡ����̶����У�����˳��Ϊ BCAFED�� (4)��û��ϴ���ձ�������������ʧ����Һ��Ũ�Ȼ�ƫ�͡�������ˮʱ�����̶��ߣ�����Һ��������Ũ��ƫ�͡�����ʱ���ӿ̶��ߣ�����Һ�������С��Ũ��ƫ�ߡ�

 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�����Ŀ���������Ʊ���Ϊ��ҵ�Σ���Ư�ס���Ƶȷ���Ӧ�ù㷺��ʵ��������ͼ��ʾװ���Ʊ��������ơ���ش��������⣺
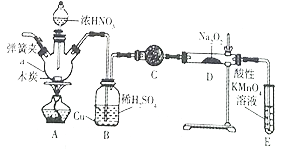
��֪:��3NaNO2+3HCl=3NaCl+HNO3+2NO��+H2O
�����������£�NO��NO2-������MnO4-��Ӧ����NO3-��Mn2+
(1)����a��������_____________��
(2)Bװ���е���Ҫ������_______��C�е��Լ�������____________��
(3)D�з�Ӧ����NaNO2�Ļ�ѧ����ʽΪ_______��Eװ�õ�������______________��
(4)����Dװ��������NaNO2
���� | ���� | ���� |
_____________ | ____________ | ��NaNO2���� |
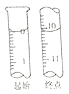
(5) NaNO2�ж������ҹ涨����Ʒ��NaNO2�������ܳ���30mg/kg����1000g��ҹ��������ȡNaNO2�������Һ������0.0050mol/L�����Ը��������Һ�ζ����ζ���ʼ���յ��Һ��λ����ͼ��ʾ�������ҹ������NaNO2�ĺ�����_______mg/kg��