��Ŀ����
����Ŀ���������ڹ���Ԫ���������̡�ͭ��п����̫���ܵ�ء����Բ��ϵȿƼ������й㷺��Ӧ�ã��ش��������⣺
��1�����ִ���ѧ�У�������______�ϵ���������������Ԫ�أ���Ϊ��������
��2��д�� Cu2+����Χ�����Ų�ʽ__________���Ƚ������̵ĵ���������(I3)����____��(���������� ��������������)��ԭ����________________��
��3����֪ [Zn(CN)4]2-���ȩ��ˮ��Һ�з�����Ӧ������һ�������� HOCH2CN�����ж���������̼ԭ�ӵ��ӻ���ʽ___________��1mol[Zn(CN)4]2-�е� �� ����Ϊ__________��
��4����ͼ�Ǿ��� Fe3O4 �ľ������þ�����һ�ִ��Բ��ϣ� �ܵ��硣
�������ж��������Ӵ���������Χ�ɵ�______(��ռ�ṹ)��϶��
�������������ӵĶѻ���ʽ��ij��������ԭ�Ӷѻ���ʽ��ͬ���öѻ���ʽ����Ϊ________��
������ Fe3O4 �����ܵ����ԭ��_________________������������Խ��߳�Ϊ a nm���� Fe3O4 ������ܶ�Ϊ________g��cm��3(�����ӵ������� NA ��ʾ)��

���𰸡� ԭ�ӹ��� 3d9 С�� Mn2+�� Fe2+�ļ۵����Ų�ʽ�ֱ�Ϊ 3d5�� 3d6�� Mn2+���� 3d5�������ȶ��ṹ����ʧȥһ���������������ϸߣ� ���Ե��������� Fe С�� Mn sp3�� sp 8NA �������� ���������ѻ� ���ӿ������ֲ�ͬ��̬�������Ӽ���ٷ���ת�� 
����������1�����ִ���ѧ�У�������ԭ�ӹ����ϵ���������������Ԫ�أ���Ϊ����������2��Cu��29��Ԫ�أ������Ų�ʽΪ��[Ar]3d104s1��Cu2+����Χ�����Ų�ʽΪ3d9��Mn2+�� Fe2+�ļ۵����Ų�ʽ�ֱ�Ϊ 3d5�� 3d6�� Mn2+���� 3d5�������ȶ��ṹ����ʧȥһ���������������ϸߣ� ���Ե��������� Fe С�� Mn����3��HOCH2CN�������ǻ���-OH��������һ��̼Ϊ����̼ԭ�ӣ��۲���Ӷ�=4+0=4���ӻ��������Ϊsp3������һ̼ԭ���뵪ԭ���γ�̼����������������1���Ҽ���2���м����۲���Ӷ�=2+![]() =2������̼ԭ���ӻ��������Ϊsp������Ϊ�Ҽ���˫������1���Ҽ���1���м�����������1���Ҽ���2���м���[Zn(CN)4]2-�к���4��C
=2������̼ԭ���ӻ��������Ϊsp������Ϊ�Ҽ���˫������1���Ҽ���1���м�����������1���Ҽ���2���м���[Zn(CN)4]2-�к���4��C![]() N����ÿ��CN-��Zn�γ�һ���Ҽ�����1mol[Zn(CN)4]2-�е� �� ����Ϊ8NA����4�������ݾ��������ӵ�λ�ù�ϵ��֪�������ж��������Ӵ���������Χ�ɵ����������϶������������ABCABC�ص��ѻ���ʽ���öѻ���ʽ����Ϊ���������ѻ��������ӿ������ֲ�ͬ��̬�������Ӽ���ٷ���ת�ƣ��� Fe3O4 �����ܵ��磻���ݾ�����̯���㣬�����к��������ӵĸ���Ϊ
N����ÿ��CN-��Zn�γ�һ���Ҽ�����1mol[Zn(CN)4]2-�е� �� ����Ϊ8NA����4�������ݾ��������ӵ�λ�ù�ϵ��֪�������ж��������Ӵ���������Χ�ɵ����������϶������������ABCABC�ص��ѻ���ʽ���öѻ���ʽ����Ϊ���������ѻ��������ӿ������ֲ�ͬ��̬�������Ӽ���ٷ���ת�ƣ��� Fe3O4 �����ܵ��磻���ݾ�����̯���㣬�����к��������ӵĸ���Ϊ![]() ���������ӵĸ���Ϊ1�������ӵĸ���Ϊ
���������ӵĸ���Ϊ1�������ӵĸ���Ϊ![]() ������������Խ��߳�Ϊ a nm����߳�Ϊxnm����Խ���Ϊ
������������Խ��߳�Ϊ a nm����߳�Ϊxnm����Խ���Ϊ![]() ������Խ��߳�
������Խ��߳�![]() = a nm����x=
= a nm����x=![]() �����Ϊx3=
�����Ϊx3=![]() ������Ϊ
������Ϊ![]() �����ܶ�
�����ܶ�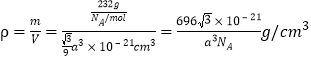 ��
��

 �������ϵ�д�
�������ϵ�д�