题目内容
【题目】BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。
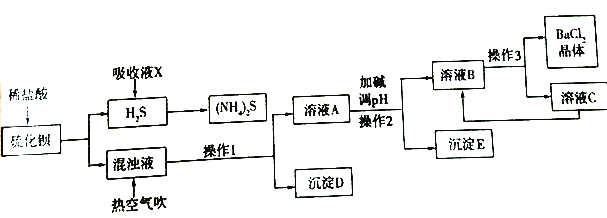
已知:室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]= 4.0×10-38
请回答下列问题:
(1)写出氯化钡的电子式________。盐酸和硫化钡反应的化学方程式为________。
(2)吸收液X的溶质是________。一定条件下向(NH4)2S溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为________。
(3)操作1的名称是________,操作3的过程是将容液B蒸发浓缩、________、过滤等。
(4)沉淀D的成分是________。
(5)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________。
(6)室温时,若加碱调溶液pH至9,则完全沉淀的离子是________ 。
(7)此工艺流程中循环利用的物质是________。
【答案】 ![]() BaS+2HCl=BaCl2+H2S↑ NH3H2O 2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓ 过滤 降温结晶 S(或硫) S2O32-+2H+=S↓+SO2↑+H2O Fe3+ BaCl2
BaS+2HCl=BaCl2+H2S↑ NH3H2O 2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓ 过滤 降温结晶 S(或硫) S2O32-+2H+=S↓+SO2↑+H2O Fe3+ BaCl2
【解析】氯化钡为离子化合物,化学式BaCl2,氯化钡的电子式为 ![]() ;根据强酸制备弱酸规律:盐酸和硫化钡反应生成氯化钡和硫化氢气体,化学方程式为BaS+2HCl=BaCl2+H2S↑;正确答案:
;根据强酸制备弱酸规律:盐酸和硫化钡反应生成氯化钡和硫化氢气体,化学方程式为BaS+2HCl=BaCl2+H2S↑;正确答案:![]() ; BaS+2HCl=BaCl2+H2S↑。
; BaS+2HCl=BaCl2+H2S↑。
(2)根据流程看出,通入吸收液X后产生了硫化铵,所以吸收液X的溶质是.NH3H2O;一定条件下向(NH4)2S溶液中通入空气,可得到单质硫和一水合氨,反应的化学方程式为. 2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓;正确答案:NH3H2O;2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓。
(3)根据流程可知,浊液通入热空气产生沉淀,所以操作1的名称是过滤;从氯化钡溶液中得到氯化钡晶体,可以采用将溶液B进行蒸发浓缩、降温结晶、过滤等操作;正确答案:过滤;降温结晶。
(4)由于 BaS+2HCl=BaCl2+H2S↑反应,会有少量硫化氢溶在氯化钡溶液中,通入热空气,会把硫化氢氧化为硫单质,所以沉淀D的成分是S(或硫);正确答案: S(或硫)。
(5)热空气吹除时会有部分HS-转变为S2O32-,S2O32-与氢离子发生氧化还原反应,生成单质硫和二氧化硫气体,离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O;正确答案:S2O32-+2H+=S↓+SO2↑+H2O。
(6) 室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]= 4.0×10-38;镁离子完全沉淀,溶液中c(OH-)2= Ksp[Mg(OH)2]/c(Mg2+)=1.8×10-11/1×10-5=1.8×10-6,c(OH-)=1.34×10-3,c(H+)=7.5×10-12,结果pH大于9;铁离子沉淀完全,溶液中c(OH-)3=Ksp[Fe(OH)3]/ c(Fe3+)= 4.0×10-38/1×10-5=4×10-33, c(OH-)=1.45×10-11, pH c(H+)=6.9×10-3, 结果pH小于9,铁离子沉淀完全;综上分析,室温时,若加碱调溶液pH至9时,完全沉淀的离子是Fe3+;正确答案:Fe3+。
(7)从流程看出,氯化钡结晶后,会有少量残留在溶液C中,通过循环利用,提高了氯化钡的利用率;正确答案:BaCl2。


