题目内容
7.实验测得乙烯和氧气组成的混合气体的密度是相同条件下氢气密度的14.5倍,由此可知乙烯的质量分数为( )
| A. | 28% | B. | 27.6% | C. | 72.4% | D. | 75% |
分析 相同条件下,气体摩尔体积相等,根据ρ=$\frac{M}{{V}_{m}}$知,不同气体的密度之比等于其摩尔质量之比,混合气体中乙烯和氧气的密度是氢气密度的14.5倍,则混合气体的摩尔质量为29g/mol,以此计算物质的量之比,可计算质量分数.
解答 解:相同条件下,气体摩尔体积相等,根据ρ=$\frac{M}{{V}_{m}}$知,不同气体的密度之比等于其摩尔质量之比,混合气体中乙烯和氧气的密度是氢气密度的14.5倍,则混合气体的摩尔质量为29g/mol,
设混合气体中氧气的物质的量为xmol、乙烯的物质的量为ymol,
M=$\frac{m}{n}$=$\frac{32x+28y}{x+y}$=29,则x:y=1:3,
则乙烯的质量分数为$\frac{3×28}{1×32+3×28}×100%$=72.4%.
故选C.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析、计算能力的考查,本题注意相对密度的运用,为解答该题的关键,难度不大.

练习册系列答案
相关题目
17.2011年为“国际化学年”,其主题是“化学 我们的生活 我们的未来”.下列对化学学科的认识错误的是
( )
( )
| A. | 我们应该珍爱生命,化学是研究、接触有毒有害物质,我们应该远离化学 | |
| B. | 化学学科主要是在微观层面上研究物质的一门以实验为基础的自然科学 | |
| C. | 化学学科肩负着开发和研究新材料、新能源等领域的重要责任 | |
| D. | 化学学科的发展对人类物质文明的进步有着重要作用 |
18.已知反应N2(g)+3H2(g)?3NH3(g)△H<0,能增大正反应速率的措施是( )
| A. | 通入N2 | B. | 扩大容器容积 | C. | 移去部分NH3 | D. | 降低体系温度 |
2. 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )| A. | NaNO2在水中的溶解性大于NH4NO2 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI、淀粉和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2 转移6 mol e- |
12.下列元素间易形成共价键的是( )
| A. | Na和Cl | B. | K和F | C. | H和Cl | D. | Ca和O |
19.工业上制备纯硅反应是SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ•mol-1(Q>0).某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
| A. | 反应过程中,若降低压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则平衡时,吸收热量为QkJ | |
| C. | 将反应的温度由T1升高至T2,则反应的平衡常数K1>K2 | |
| D. | 当反应吸收热量为0.25QkJ时,生成的HCl恰好能与1 molNaOH反应 |
16.在下列溶液中,能大量共存的离子组是( )
| A. | 能使pH试纸显蓝色的溶液中:K+、Ba2+、H+、Br- | |
| B. | 加入Al能放出H2的溶液中:K+、Na+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| D. | 能使石蕊试液显红色的溶液中:K+、SO42-、S2-、CO32- |
1.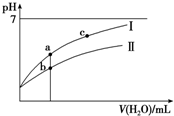 已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
 已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
