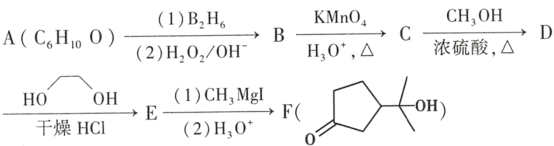
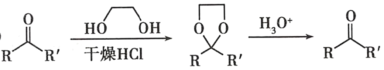
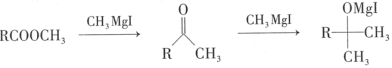
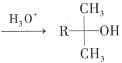
题目内容
【题目】下列说法错误的是( )
A.用惰性电极电解 Na2SO4 溶液,当 2 mol 电子转移时,可加入 18 g 水恢复
B.用惰性电极电解 1 L 1 mol/L CuSO4 溶液,当加入 1 mol Cu(OH)2 恢复电解前浓度时, 电路中转移了 4 mol e-
C.用惰性电极电解 1 mol CuSO4 和 1 mol NaCl 的混合溶液,溶液的 pH 先减小后增大
D.要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
【答案】C
【解析】
A.用惰性电极电解![]() 溶液,实质为电解水,根据电子守恒计算消耗水的物质的量;
溶液,实质为电解水,根据电子守恒计算消耗水的物质的量;
B.需加入1mol![]() 恢复电解前浓度,1mol
恢复电解前浓度,1mol![]() 相当于1molCuO和
相当于1molCuO和![]() ,结合电子守恒分析;
,结合电子守恒分析;
C.阳离子在阴极得电子能力![]() ,阴离子在阳极失电子能力
,阴离子在阳极失电子能力![]() ,电解时阴极电极反应:
,电解时阴极电极反应:![]() ,1mol
,1mol![]() 完全反应转移2mol电子,阳极电极反应:
完全反应转移2mol电子,阳极电极反应:![]() ,1mol
,1mol![]() 完全反应转移1mol电子,根据电子守恒规律,阳极电极反应还有:
完全反应转移1mol电子,根据电子守恒规律,阳极电极反应还有:![]() ,据此分析溶液pH变化;
,据此分析溶液pH变化;
D.铜与稀硫酸不反应,若要实现该反应,则需在电解池中进行,铜化合价升高,说明铜失去电子做阳极。
![]() .用惰性电极电解
.用惰性电极电解![]() 溶液,相当于电解水:2H2O
溶液,相当于电解水:2H2O![]() 2H2↑+O2↑,该反应转移4mol电子时,消耗水2mol,当有2mol电子转移时,消耗水1mol,即可加入18g水恢复到原状态,A正确;
2H2↑+O2↑,该反应转移4mol电子时,消耗水2mol,当有2mol电子转移时,消耗水1mol,即可加入18g水恢复到原状态,A正确;
B.用惰性电极电解1L![]()
![]() 溶液,电解反应为
溶液,电解反应为![]() ,当
,当![]() 全部被还原成铜时,生成铜1mol,转移电子的物质的量为2mol,若要恢复到电解前的状态,需要加氧化铜的物质的量为1mol,现需加入1mol
全部被还原成铜时,生成铜1mol,转移电子的物质的量为2mol,若要恢复到电解前的状态,需要加氧化铜的物质的量为1mol,现需加入1mol![]() 恢复电解前浓度,说明还有1mol水发生了电解反应,根据
恢复电解前浓度,说明还有1mol水发生了电解反应,根据![]() 可知,该反应转移4mol电子时,消耗水2mol,当有1mol水被电解时,转移电子的物质的量为2mol,所以整个电路中转移了
可知,该反应转移4mol电子时,消耗水2mol,当有1mol水被电解时,转移电子的物质的量为2mol,所以整个电路中转移了![]() ,B正确;
,B正确;
C.阳离子在阴极得电子能力![]() ,阴离子在阳极失电子能力
,阴离子在阳极失电子能力![]() ,所以用惰性电极电解1mol
,所以用惰性电极电解1mol![]() 和1molNaCl的混合溶液,阴极电极反应:
和1molNaCl的混合溶液,阴极电极反应:![]() ,1mol
,1mol![]() 完全反应转移2mol电子,阳极电极反应:
完全反应转移2mol电子,阳极电极反应:![]() ,1mol
,1mol![]() 完全反应转移1mol电子,根据电子守恒规律,阳极电极反应还有:
完全反应转移1mol电子,根据电子守恒规律,阳极电极反应还有:![]() ,转移1mol电子,消耗
,转移1mol电子,消耗![]() 的物质的量为1mol,溶液中的氢离子的物质的量增大1mol,所以电解后溶液的pH减小,C错误;
的物质的量为1mol,溶液中的氢离子的物质的量增大1mol,所以电解后溶液的pH减小,C错误;
D.Cu与稀硫酸不反应,若要实现![]() 稀
稀![]() ,则需在电解池中进行,Cu连在电源的正极上做阳极,铜失电子,发生氧化反应,D正确;
,则需在电解池中进行,Cu连在电源的正极上做阳极,铜失电子,发生氧化反应,D正确;
答案选C。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】实验室中有一未知浓度的醋酸,某学生用0.1000 mol·L-1 NaOH标准溶液进行测定醋酸的浓度的实验,取20.00mL待测醋酸放入锥形瓶中,并滴加2~3滴指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:
实验编号 | 待测醋酸的体积/mL | NaOH溶液的浓度/mol·L-1 | 消耗NaOH溶液的体积/mL |
1 | 20.00 | 0.1000 | 25.18 |
2 | 20.00 | 0.1000 | 23.06 |
3 | 20.00 | 0.1000 | 22.98 |
(1)该实验中指示剂最好选用___________,滴定达到终点的标志是_____________________。
(2)排除碱式滴定管尖嘴中气泡的方法应采用以下_________操作(填甲/乙/丙),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)根据上述数据,可计算出该醋酸的浓度为_________mol·L-1(保留小数点后4位)。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________。
A.用滴定管取20.00mL待测醋酸,使用前,水洗后未用待测醋酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消关