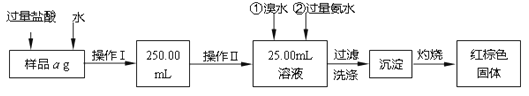
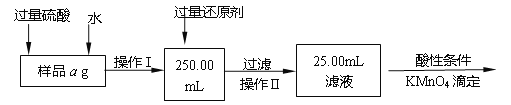
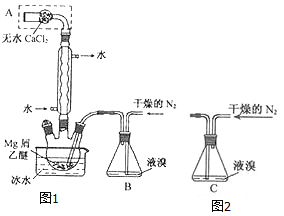
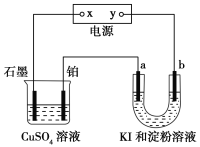
题目内容
【题目】下列变化不能用勒夏特列原理解释的是( )
A. 氯水宜保存在低温、避光条件下
B. H2、I2、HI混合气体加压后颜色变深
C. SO2催化氧化成SO3的反应,往往加入过量的空气
D. 打开汽水瓶,看到有大量的气泡逸出
【答案】B
【解析】试题分析:A、光照新制氯水,Cl2+H2O![]() HCl+HClO,2HClO=2HCl+O2↑次氯酸分解,促进氯气和水反应的平衡正向进行,氯气减小,黄绿色逐渐变浅,可以用勒夏特列原理解释,A不选;B、由H2、I2(g)、HI组成的平衡体系,反应前后气体体积不变,加压后颜色加深是因为体积减小导致难度增大,不能用勒夏特列原理解释,B选;C、SO2转化为三氧化硫的反应是可逆反应,增大氧气的浓度平衡向正反应方向进行,可以用勒夏特列原理解释,C不选;D、开启汽水瓶后,瓶中马上泛起大量泡沫,是压强对其影响导致的,属于可逆反应,可以用勒夏特列原理解释,D不选;答案选B。
HCl+HClO,2HClO=2HCl+O2↑次氯酸分解,促进氯气和水反应的平衡正向进行,氯气减小,黄绿色逐渐变浅,可以用勒夏特列原理解释,A不选;B、由H2、I2(g)、HI组成的平衡体系,反应前后气体体积不变,加压后颜色加深是因为体积减小导致难度增大,不能用勒夏特列原理解释,B选;C、SO2转化为三氧化硫的反应是可逆反应,增大氧气的浓度平衡向正反应方向进行,可以用勒夏特列原理解释,C不选;D、开启汽水瓶后,瓶中马上泛起大量泡沫,是压强对其影响导致的,属于可逆反应,可以用勒夏特列原理解释,D不选;答案选B。

练习册系列答案
相关题目
【题目】在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(s),所得实验数据如下表:
M(g)+N(s),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列说法不正确的是:
A. 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L·min)
B. 实验②中,该反应的平衡常数K=12.5
C. 实验②中,达到平衡时,a大于0.16
D. 正反应为放热反应