题目内容
【题目】某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验:
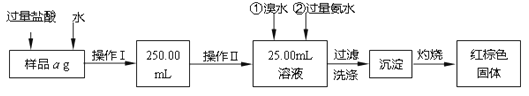
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、250mL容量瓶外,还必须有 。(填仪器名称)
(2)溶解混合物时,加入盐酸的作用是 ;操作II中加入氯水的作用是 ;
(3)写出过量氨水参加反应的离子方程式 ;
(4)将沉淀物置于坩埚中灼烧至质量不再减少后冷却至室温,坩埚质量是b g,坩埚与加热后固体总质量是c g,则样品中铁元素的质量分数是 ;
Ⅱ.有同学提出,还可以采用以下方法来测定
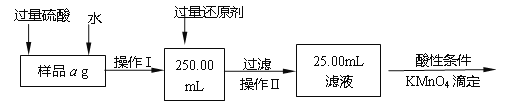
(5)加过量还原剂可否用铁粉 ;
(6)若用酸性 KMnO4溶液滴定含Fe2+的溶液,写出反应的离子方程式 ;
【答案】(1)胶头滴管(2)抑制Fe2+和Fe3+水解;将Fe2+氧化成Fe3+
(3)Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+(4)7(c-b)/a×100%
(5)否(6)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
【解析】
试题分析:(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,操作I所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有250mL容量瓶;
(2)因Fe2+、Fe3+均易水解,在溶解混合物时,可加入盐酸抑制Fe2+和Fe3+水解;操作II中加入氯水可将Fe2+氧化成Fe3+;
(3)向含有Fe3+的溶液中滴加过量氨水有红褐色沉淀生成,发生反应的离子方程式为Fe3+ + 3NH3·H2O = Fe(OH)3↓+ 3NH4+;
(4)将沉淀物置于坩埚中灼烧至质量不再减少后冷却至室温,残余固体为Fe2O3,质量为(c-b)g,物质的量为(c-b)g÷160g/mol=(c-b)/160mol,则样品中铁元素的质量分数是[(c-b)/160 mol × 2 × 56 g/mol × (250÷25)] ÷ ag × 100% = 7(c-b)/a ×100%。
(5)还原剂不能用铁,因为有铁粉会和过量硫酸反应生成硫酸亚铁,铁自身的氧化产物是Fe2+,再用高锰酸钾滴定,多消耗氧化剂产生误差,干扰原混合物的铁元素的测定;
(6)用酸性高锰酸钾溶液滴定Fe2+时发生的离子反应为5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。