题目内容
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是
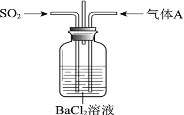
A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
【答案】A
【解析】
由强酸制弱酸的原理可知,SO2与BaCl2溶液不反应,不可能生成BaSO3沉淀,通入另一种气体产生白色沉淀,应有两种情况,一是溶液中有较多的SO32-离子,或发生氧化还原反应生成SO42-离子,否则不生成沉淀。
A项、大理石和稀盐酸制得二氧化碳气体,二氧化碳和二氧化硫与氯化钡均不反应,不会产生沉淀物,故A正确;
B项、NaOH和NH4Cl共热反应生成氨气,通入氨气溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,故B错误;
C项、Cu和浓硝酸生成二氧化氮气体,NO2与水反应生成具有氧化性的硝酸,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故C错误;
D项、MnO2和浓盐酸共热反应生成氯气,Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故D错误。
故选A。

 53随堂测系列答案
53随堂测系列答案【题目】按要求填空:
(1)已知R2-离子的核内有n个中子,R的质量数为M,则mg R2-离子里含有电子的物质的量为 ____________mol。
(2)X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为_____ 。
(3)已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则元素非金属性由强到弱顺序为:____________ ;气态氢化物的稳定性由强到弱顺序为:______________ 。
(4).甲、乙两种非元素:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。
能说明甲的非金属性比乙的非金属性强的有________________
(5)下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验序号 | 金属质量/g | 金属状态 | c(H2SO4) mol/L | 实验温度/℃ | 金属消失的时间/s |
1 | 0.10 | 丝 | 0.7 | 25 | 240 |
2 | 0.10 | 丝 | 1.0 | 25 | 190 |
3 | 0.10 | 粉末 | 1.0 | 25 | 120 |
4 | 0.10 | 粉末 | 1.0 | 40 | 40 |
分析上述数据,回答下列问题:
①实验1、
②实验2、3可得出的结论是_________________________。
③实验3、4可得出的结论是______________________。
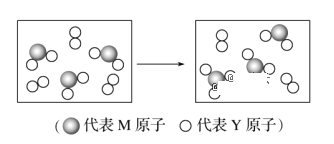
(6)下图表示由M、Y两元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:______________________。