题目内容
【题目】金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题。
(1)含碳量在0.03%2%之间某合金,是目前使用量最大的合金,这种合金是___。
A.铝合金 B.青铜 C.镁合金 D.钢
(2)FeCl3溶液用于腐蚀铜箔印刷线路板,反应的离子方程式为___。
(3)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是__(填字母),大量增加的离子有___(填化学式)。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(4)4Fe(NO3)2的高纯度结晶体是一种紫色潮解性固体,适合于制磁性氧化铁纳米粉末,工业上用废铁屑(含Fe和Fe2O3及其它不反应的物质)制取Fe(NO3)2晶体的方法如图:
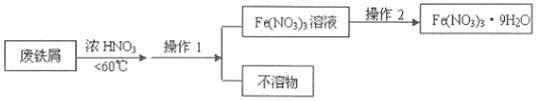
①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为___。
②磁性氧化铁的化学式为___,试写出Fe2O3与硝酸反应的离子方程式___。
③操作1的名称为___,操作2的步骤为:___、___,过滤洗涤。
【答案】D 2Cu+2Fe3+=2Fe2++Cu2+ BC Fe3+、Na+ 4HNO3(浓)![]() 4NO2↑+O2↑+H2O Fe3O4 Fe2O3+6H+=2Fe3++3H2O 过滤 蒸发浓缩 冷却结晶
4NO2↑+O2↑+H2O Fe3O4 Fe2O3+6H+=2Fe3++3H2O 过滤 蒸发浓缩 冷却结晶
【解析】
(1)目前使用量最大的合金是铁合金,据此分析解答;
(2)铁离子具有氧化性,可氧化铜,生成亚铁离子和铜离子;
(3)加入过量的Na2O2后,过氧化钠氧化亚铁离子,Al3+转化为偏铝酸根,Mg2+、Fe3+、Cu2+转化为氢氧化物沉淀,灼烧固体得到氧化镁、氧化铜、氧化铁,投入过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,据此分析解答;
(4)①浓硝酸不稳定,在加热条件下能分解生成二氧化氮、氧气和水;②磁性氧化铁为四氧化三铁;氧化铁与硝酸反应生成硝酸铁和水;③根据流程图操作1是分离固体和溶液的方法;操作2是从溶液中制取九水合硝酸铁,据此分析解答。
(1)目前使用量最大的合金是铁合金;生铁和钢都是铁的合金,生铁中碳的含量在2.0%--4.3%之间,钢中的含碳量在0.03%--2.0%之间,所以D符合,故答案为:D;
(2)铁离子具有氧化性,可氧化铜,反应的离子方程式为2Cu+2Fe3+═2Fe2++Cu2+,故答案为:2Cu+2Fe3+═2Fe2++Cu2+;
(3)过氧化钠具有强氧化性,能氧化亚铁离子,过氧化钠与水反应生成氢氧化钠,加入过量的Na2O2后,Al3+转化为偏铝酸根,Mg2+、Fe3+、Cu2+转化为氢氧化物沉淀,灼烧固体得到氧化镁、氧化铜、氧化铁,投入过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+,大量增加的是Fe3+、Na+,故答案为:BC;Fe3+、Na+;
(4)①浓硝酸具有强挥发性,且不稳定,在加热条件下能分解生成二氧化氮、氧气和水,反应方程式为:4HNO3(浓)![]() 4NO2↑+O2↑+H2O,故答案为:4HNO3(浓)
4NO2↑+O2↑+H2O,故答案为:4HNO3(浓)![]() 4NO2↑+O2↑+H2O;
4NO2↑+O2↑+H2O;
②磁性氧化铁的化学式为Fe3O4,氧化铁与硝酸反应生成硝酸铁和水,离子方程式为:Fe2O3+6H+═2Fe3++3H2O,故答案为:Fe3O4;Fe2O3+6H+═2Fe3++3H2O;
③用废铁屑(含Fe和Fe2O3及其它不反应的物质)与浓硝酸反应,通过操作1除去与浓硝酸不反应的物质,因此操作1为过滤;从溶液中制取九水合硝酸铁,需蒸发浓缩、冷却结晶,故答案为:过滤;蒸发浓缩、冷却结晶。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
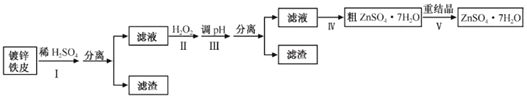
蓝天教育暑假优化学习系列答案【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
相关信息如下:
①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
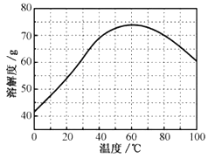
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是__。
②步骤Ⅰ可用于判断镀锌层完全反应的实验现象是__。
(2)步骤Ⅱ须加入过量H2O2理由是__。
(3)步骤Ⅲ,合适的pH范围是__。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
请给出上述操作的正确顺序__。(操作可重复使用)
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO47H2O晶体颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择__方式进行冷却结晶。
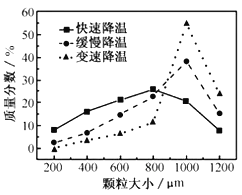
A.快速降温 B.缓慢降温 C.变速降温
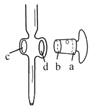
(6)①ZnSO47H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是__。
A.图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
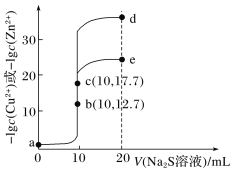
②图中滴定终点是的读数是___mL。

【题目】在测定硫酸铜晶体中结晶水含量的实验操作中:
(1)加热前应将晶体放在__________中研碎,加热是放在__________中进行,加热失水后,应放在__________中冷却。
(2)判断是否完全失水的方法是______________________________________________。
(3)下面是某学生一次实验的数据,请完成计算,填入下面的表格中。
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | 测得晶体中结晶水个数 |
11.7 g | 22.7 g | 17. 6 g | _________ |
(4)这次实验中产生误差的原因可能是__________(填写字母)所造成。
A.硫酸铜晶体中含有易挥发性杂志 B.实验前晶体已部分变白
C.加热时固体部分变黑 D.加热失水后漏置在空气中冷却
(5)已知在坩埚中加热硫酸铜晶体,受热分解过程如下:
CuSO4·5H2O![]() CuSO4·3H2O
CuSO4·3H2O ![]() CuSO4·H2O
CuSO4·H2O ![]() CuSO4
CuSO4
有人借助如图封闭装置进行硫酸铜晶体脱水实验,回答下列问题:
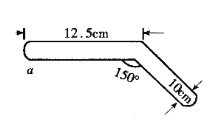
①本实验可用于验证的化学定律是_____________________________。
②a处加热片刻后现象:______________________________________。
③你认为此装置设计是否合理.科学?如不合理,请写出理由:___________________________________________________________________________________________________。